
| A. | 化学反应都是吸热反应 | |
| B. | 化学反应都是放热反应 | |
| C. | 物质发生化学反应都伴随着能量变化 | |
| D. | 有能量变化的物质变化都是化学变化 |
分析 A、化学反应有的是吸热反应,有的为放热反应;
B、化学反应有的是吸热反应,有的为放热反应;
C、依据化学反应实质是反应物化学键断裂化学键吸收能量,生成物形成化学键放出热量,反应过程中一定伴随能量变化;
D、伴有能量变化的物质变化不一定发生化学反应;
解答 解:A、化学反应有的是吸热反应,有的为放热反应,例如燃烧为放热反应,故A错误;
B、化学反应有的是吸热反应,有的为放热反应,例如碳酸钙分解为吸热反应,故B错误;
C、化学反应实质是反应物化学键断裂化学键吸收能量,生成物形成化学键放出热量,反应过程中一定伴随能量变化,故C正确;
D、伴有能量变化的物质变化不一定是化学变化,如灯泡发光过程中有热能变化,故D错误;
故选:C.
点评 本题考查了化学反应能量变化分析判断,化学反应实质的理解是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色)═N2O4(g) (无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色)═N2O4(g) (无色),如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.北京化工大学新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )
流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.北京化工大学新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )| A. | a为负极,b为正极 | |
| B. | 该电池工作时PbO2电极附近溶液的pH增大 | |
| C. | a极的电极反应为Cu-2e-═Cu2+ | |
| D. | 调节电解质溶液的方法是补充CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何氧化还原反应原则上都可以设计成原电池 | |
| B. | 原电池中电子从负极经导线流入正极 | |
| C. | 原电池中正极得电子数与负极失电子数一定相等 | |
| D. | 铜-锌-稀硫酸组成的原电池,电解质溶液中H+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊试液变红 | |
| B. | 与铜反应放出NO气体生成Cu(NO3)2和H2O | |
| C. | 与Na2CO3反应放出CO2气体生成NaNO3和H2O | |
| D. | 与S单质混合共热时生成H2SO4和NO2、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
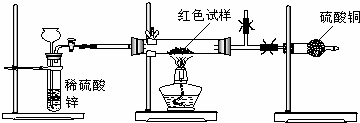
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
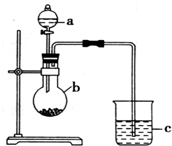 “元素的最高价氧化物对应的水化物酸性越强非金属性越强”某同学欲运用这一观点来验证硫和碳两元素的得电子的能力强弱,设计实验如图所示,请回答:
“元素的最高价氧化物对应的水化物酸性越强非金属性越强”某同学欲运用这一观点来验证硫和碳两元素的得电子的能力强弱,设计实验如图所示,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com