
| A. | Y元素最高价氧化物对应水化物化学式H2YO4 | |
| B. | 原子半径由大到小的顺序为:Y>Z>X | |
| C. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 | |
| D. | X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
分析 X、Y、Z、W为四种短周期主族元素,W是短周期主族元素中原子半径最大的,则W为Na;X原子最外层电子数是核外电子层数的3倍,原子只能有2个电子层,最外层电子数为6,故X为O元素;X、Z同族,则Z为S硫元素;Y、Z同周期,处于第三周期,Y的最高正价与最低负价代数和为6,可推知Y为Cl,结合元素周期律与元素化合物性质解答.
解答 解:X、Y、Z、W为四种短周期主族元素,W是短周期主族元素中原子半径最大的,则W为Na;X原子最外层电子数是核外电子层数的3倍,原子只能有2个电子层,最外层电子数为6,故X为O元素;X、Z同族,则Z为S硫元素;Y、Z同周期,处于第三周期,Y的最高正价与最低负价代数和为6,可推知Y为Cl.
A.Y为Cl元素,最高价氧化物对应水化物的化学式HClO4,故A错误;
B.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Z(S)>Y(Cl)>X(O),故B错误;
C.X与W形成的两种化合物分别为Na2O、Na2O2,氧化钠由钠离子与氧离子构成,过氧化钠由钠离子与过氧根离子构成,二者阴、阳离子物质的量之比均为1:2,故C正确;
D.氢化物稳定性与元素非金属性一致,由于O元素非金属性强于S,故O元素氢化物更稳定,故D错误,
故选C.
点评 本题考查结构性质位置关系综合应用,关键是明确元素种类,注意对元素周期律的理解掌握.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中:K,CH3OH,Br-,NO3- | |
| B. | 在氨水溶液中:Al3+,NO3-,Cl-,Ag+ | |
| C. | 某透明澄清的溶液中:NH4+,Fe3+,NO3-,Cl- | |
| D. | 能使甲基橙显红色的溶液:K+,Cr2O72-,CH2CH2OH,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | HOOCCOOH | D. | (CH3)3CCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
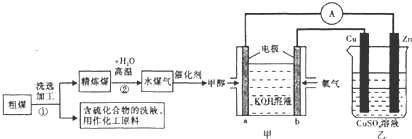
| 实验组 | 温度/C | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| C | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | … | 6 |
| 2 | 900 | 6 | 3 | … | 1.5 | 3 |
| 3 | 900 | … | … | … | … | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷自燃而氮气在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(A2-)c(H2A) | |
| B. | Na2CO3溶液:c(H+)-c(OH-)=c(HCO3-)+2c(CO32-)-c(Na+) | |
| C. | 向NaOH溶液中滴入HCOOH溶液后溶液显碱性:c(HCOO-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1mol•L-1HF溶液与0.1mol•L-1KF溶液等体积混合:c(F-)+c(HF)=0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
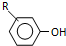 $→_{OH-}^{(CH_{3})_{2}SO_{4}}$
$→_{OH-}^{(CH_{3})_{2}SO_{4}}$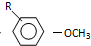 $\stackrel{浓HI}{→}$
$\stackrel{浓HI}{→}$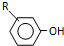
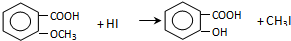 .
.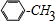 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$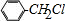 +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.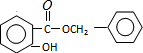 .
. (或
(或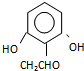 ).
).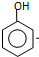 $\stackrel{反应条件1}{→}$I$→_{OH-}^{(CH_{3})_{2}SO_{4}}$J$\stackrel{反应条件2}{→}$K$\stackrel{反应条件3}{→}$
$\stackrel{反应条件1}{→}$I$→_{OH-}^{(CH_{3})_{2}SO_{4}}$J$\stackrel{反应条件2}{→}$K$\stackrel{反应条件3}{→}$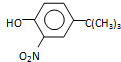 反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为
反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为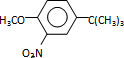 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
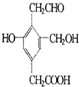 某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
某有机物的结构简式如图,若等物质的量的该有机物分别与Na、NaOH、Na2CO3、NaHCO3恰好反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )| A. | 3:3:2:1 | B. | 6:4:3:2 | C. | 1:1:1:1 | D. | 3:2:2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com