
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
【答案】
(1)S C
(2)V形 直线形 SO2 因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
(3)Cr 四 1s22s22p63s23p63d54s1 +6
(4)F—H…F F—H…O O—H…F O—H…O
【解析】由“X原子核外的M层中只有两对成对电子”则X为硫元素。“Y原子核外的L层电子数是K层的两倍”则Y为碳元素。“Z是地壳内含量最高的元素”则Z为氧元素。“Q的核电荷数是X与Z的核电荷数之和”则Q为铬元素,其元素符号为Cr,位于元素周期表的第四周期,其核外电子排布式为:1s22s22p63s23p63d54s1,在形成化合物时其最高化合价为+6。“E在元素周期表的各元素中电负性最大”即E为氟(F)元素,在E的氢化物(HF)溶液中存在的所有氢键为:F—H…O、O—H…F、O—H…O。XZ2与YZ2分别为SO2和CO2分子,其立体结构分别为V形(角形)和直线形,在相同条件下二者在水中溶解度较大的是SO2,原因是CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中溶解度较大。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
(1)中国古代四大发明之一——黑火药,它的爆炸反应为
 (已配平)
(已配平)
①除S外,上列元素的电负性从大到小依次为 。
②在生成物中,A的晶体类型为 ,含极性共价键的分子的中心原子轨道杂化类型为 。
③已知 与
与 结构相似,推算HCN分子中
结构相似,推算HCN分子中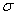 键与
键与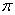 键数目之比为 。
键数目之比为 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为 , 的未成对电子数是 。
的未成对电子数是 。
(3 )在
)在 的水溶液中,一定条件下存在组成为
的水溶液中,一定条件下存在组成为 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
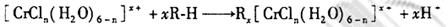
交换出来的 经中和滴定,即可求出x和n,确定配离子的组成。将含0.0015 mol
经中和滴定,即可求出x和n,确定配离子的组成。将含0.0015 mol  的溶液,与R-H完全交换后,中和生成的
的溶液,与R-H完全交换后,中和生成的 需浓度为0.1200 mol·L-1 NaOH溶液25.00 ml,该配离子的化学式为 。
需浓度为0.1200 mol·L-1 NaOH溶液25.00 ml,该配离子的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物,按其晶体的熔点由高到低排列正确的是
A.SiO2 CsCl CBr4 CF4 B.SiO2 CsCl CF4 CBr4
C.CsCl SiO2 CBr4 CF4 D.CF4 CBr4 CsCl SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
在基态多电子原子中,关于核外电子能量的叙述错误的是
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是
A.13C和 14C属于同一种元素,它们互为同位素
14C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是 ;
(2)B和C的分子式分别是 和 ;C分子的立体结构呈 形,该分子属于 分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是 ,该反应的化学方程式为 ;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 编号 | 叙述I | 叙述II |
| A | MgO和Al2O3的熔点都很高 | Mg(OH)2和Al(OH)3可以作阻燃剂 |
| B | SO2具有漂白性 | SO2能使高锰酸钾酸性溶液褪色 |
| C | AlCl3的熔融态不导电 | AlCl3是共价化合物 |
| D | 硬铝是合金 | 其熔点比金属铝的熔点高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com