
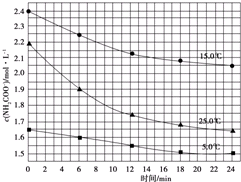
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总液度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
分析 (1)①反应是一个气体量增加的反应,压强对化学反应的平衡有影响,结合常用判断化学平衡的判据解答;
②根据表中25℃时的数据计算分解平衡常数,平衡常数的表达式为K=c2(NH3)c(CO2);
③氨基甲酸铵的分解反应为NH2COONH4(s)?2NH3(g)+CO2(g),恒温下压缩容器体积,等效于对体系加压,结合勒夏特列原理知识解答;
④根据表中数据判断分解反应的焓变,反应是气体量增加的反应,气体量增加有助于体系混乱度增加,熵变也增加;
(2)结合25℃时,时间-浓度变化图计算化学反应速率,起始浓度为2.2mol/L,6min时浓度为1.9mol/L,化学反应平均速率为$\overline{r}=\frac{△c}{△t}$.
解答 解:(1)①A.速率关系应为$\frac{v(N{H}_{3})}{2}=v(C{O}_{2})$,且应指明是正反应速率还是逆反应速率,不可以作为判据,故A不选;
B.反应的压强取决于产物的压强,当体系压强不发生改变时,可以判断反应达到平衡,可以作为判据,故B可选;
C.密闭容器中混合气体的密度为$ρ=\frac{{m}_{混}}{V}$,混合气体都是产物,当混合气体的密度不再改变时,即m混不发生改变,可以判断反应已经达到平衡,可作为判据,故C可选;
D.产物中氨气于二氧化碳的体积比在整个反应中始终满足2:1,氨气的体积分数始终不变,不可作为化学反应达到平衡的判据,故D不选.
故选BC;
②根据表中数据,当温度为25.0℃时,体系平衡总压强为12.0kPa,平衡气体总浓度为4.8×10-3mol/L,由于整个反应中,氨气与二氧化碳的量始终满足2:1的关系,则平衡时候,$c(N{H}_{3})=\frac{2}{3}c$,$c(C{O}_{2})=\frac{1}{3}c$,c=4.8×10-3mol/L,根据平衡常数表达式K=c2(NH3)c(CO2),则$K=(\frac{2}{3}c)^{2}×\frac{1}{3}c$=$(\frac{2}{3}c)^{2}×\frac{1}{3}c$=$\frac{4}{27}{c}^{3}$=1.6×10-8mol3/L3.故答案为:K=c2(NH3)c(CO2)=$(\frac{2}{3}c)^{2}×\frac{1}{3}c=1.6×1{0}^{-8}mo{l}^{3}/{L}^{3}$;
③氨基甲酸铵的分解反应为NH2COONH4(s)?2NH3+CO2,生成物均为气体,在恒温下压缩容器体积,等效于对整个反应体系加压,由勒夏特列原理,反应朝着减压方向,即逆反应方向移动,导致氨基甲酸铵固体质量的增加.故答案为:增加;
④由表中各温度下的数据,随着温度的增加,产物总压强,总浓度均增加,说明升高温度,有利于产物的增加,即推动反应的平衡正向移动,说明正反应是吸热反应,则反应的焓变△H>0;反应是气体量增加的反应,气体量增加有助于体系的混乱度增加,熵变也增加,则熵变△S>0.故答案为:>;>;
(2)由时间-浓度图可知,随着反应的进行,反应物的浓度减小,生成物的浓度增加,0-6min时,根据反应方程式:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,在25℃时,从图象上对应找到25℃时的浓度变化曲线,0时刻,氨基甲酸铵的浓度为2.2mol/L,6min时刻,氨基甲酸铵的浓度为1.9mol/L,则氨基甲酸铵下降的浓度为△c=2.2mol/L-1.9mol/L=0.3mol/L,则0-6min内,氨基甲酸铵水解反应的平均速率为$\overline{r}=\frac{△c}{△t}=\frac{0.3mol/L}{6min}=0.05mol/(L•min)$.
故答案为:0.05mol/(L•min).
点评 本题考察了化学平衡的移动,平衡常数的计算,化学反应速率,焓变和熵变等相关知识点,考查较为综合,注意高中的化学平衡常数一般是实验平衡常数,需带单位计算,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | l8gNH4+中所含的电子数为11NA | |
| B. | 常温下,1L PH=1的H2SO4溶液中含有的H+的数目为0.2NA | |
| C. | 标准状况下,22.4LCl2完全溶于水时形成氯水时,转移电子数为NA | |
| D. | 常温常压下,3.4gH2O2含有极性键的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏、海水晒盐、燃煤烟气的脱硫、菜籽中提取菜籽油等过程都是物理变化 | |
| B. | CO2可与H2在一定条件下转化为CO、CH3OH、CH3OCH3、HCOOH以及各种低碳烃,这些措施符合低碳经济的发展要求 | |
| C. | 泡过高锰酸钾溶液的硅藻土放于新鲜水果箱内是为了催熟水果 | |
| D. | 生活中常用可溶性铝盐和铜盐净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
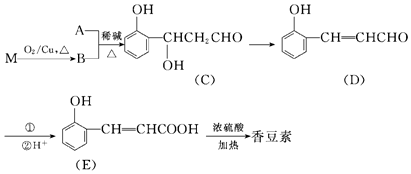
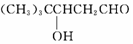 $\stackrel{-H_{2}O}{→}$(CH3)3CCHO=CHCHO
$\stackrel{-H_{2}O}{→}$(CH3)3CCHO=CHCHO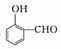 .
.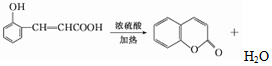 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2C2O4是氧化剂 | B. | KClO3是还原剂 | ||
| C. | H2C2O4被氧化 | D. | H2SO4发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,向水中加入少量固体NaHSO4,c(H+)增大,Kw不变 | |
| B. | 向0.1 mol•L-1CH3COOH溶液中加入少量的CH3COONa晶体,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$减小 | |
| C. | 常温下,向BaCO3饱和溶液中加入Na2CO3固体,c(Ba2+)减小,BaCO3的Ksp减小 | |
| D. | 一定条件下,将一定浓度的CH3COONa溶液加水稀释,溶液中所有离子的浓度都减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com