
【题目】世界能源消费的90%以上依靠化学技术。
(1)工业制氢的一个重要反应是利用CO还原H2O(g)。
已知:C(石墨,s)+O2(g)═CO2(g) △H=-394k J/mol
2C(石墨,s)+O2(g)═2CO(g) △H=-222k J/mol
H2(g)+1/2O2(g)═H2O(g) △H=-242k J/mol
则CO还原H2O(g)的热化学方程式为_________________________。
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池的工作时的负极电极反应:_______。
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应__________。
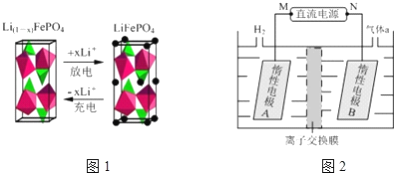
(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如上图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的________(填“正”或“负”)极,B极区电解液为_______溶液(填化学式),该离子交换膜是________(填“阳”或“阴”)离子交换膜。
(5)上图所示装置(阴、阳极均为惰性电极)可用于电解尿素(CONH2)2)的碱性溶液制取氢气。该装置中阳极的电极反应式为___________________________。
【答案】 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ/mol H2-2e-+2OH-==2H2O LiFePO4—xe-=Li(1-X)FePO4+xLi+ 负 LiCl 阳 CO(NH2)2—6e-+8OH-=CO32-+N2+6H2O
【解析】(1)已知:①C(石墨,s)+O2(g)═CO2(g) △H=-394k J/mol,②2C(石墨,s)+O2(g)═2CO(g) △H=-222k J/mol;③H2(g)+1/2O2(g)═H2O(g) △H=-242k J/mol;由盖斯定律,①—③—②/2得:CO(g)+H2O(g)=CO2(g)+H2(g),ΔH=ΔH1—ΔH3—ΔH2/2=-41kJ/mol;则CO还原H2O(g)的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ/mol。
(2)氢氧燃料电池通氧气的极为正极,通氢气的有为负极,电解质溶液为碱性时负极电极反应式为H2-2e-+2OH-==2H2O。
(3)充电时发生氧化反应为阳极,电极反应式为:LiFePO4﹣xe﹣═ Li(1﹣x)FePO4+xLi+
,故答案为:LiFePO4﹣xe﹣═ Li(1﹣x)FePO4+xLi+。
(4)电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,左侧生成氢气,则A中氢离子放电,可知A为阴极,M是负极,在A中制备LiOH,Li+由A经过阳离子交换膜向B移动,离子交换膜是阳离子交换膜;B中为LiCl溶液,氯离子放电生成氯气,Cl2将I2氧化成更高价态的碘的化合物,导致蓝色褪去。
(5)用惰性电极电解尿素(CONH2)2)的碱性溶液制取氢气。阳极上尿素失电子生成氮气,其电极反应式为:CO(NH2)2—6e-+8OH-=CO32-+N2+6H2O。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.植物油氢化产物属于烃类
B.制作集成电路板的酚醛树脂可导电
C.石油经催化裂化与裂解可获得较多的气态烯烃等产品
D.鸡蛋清中滴加1%醋酸铅溶液产生的沉淀能重新溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
A. 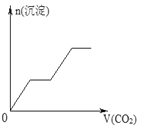 B.
B. 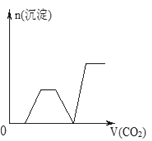
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表符号中“2”的含义正确的一组是( )
| 2He | Cl2 | Ca2+ | |
A | 质量数 | 中子数 | 质子数 | 电荷数 |
B | 质量数 | 质子数 | 原子数 | 电荷数 |
C | 质子数 | 中子数 | 原子数 | 电子数 |
D | 质量数 | 质子数 | 分子数 | 电荷数 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Pauling的杂化轨道理论解释甲烷分子的四面体结构,下列说法不正确的是( )
A.C原子的四个杂化轨道的能量一样
B.C原子的sp3杂化轨道之间夹角一样
C.C原子的4个价电子分别占据4个sp3杂化轨道
D.C原子有1个sp3杂化轨道由孤对电子占据
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
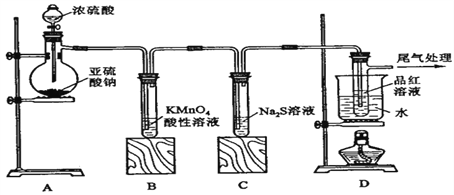
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是______________,其中发生反应的化学方程式为_______________________________________________________________;
(2)实验过程中,装置B、C中发生的现象分别是___________、___________,这些现象分别说明SO2具有的性质是__________和___________;装置B中发生反应的离子方程式为_______________________________________________________________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_____________________________;
(4)尾气可采用_____________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课外学习小组为检验溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使红色石蕊试纸变蓝.由该实验能够得到的正确结论是( ) 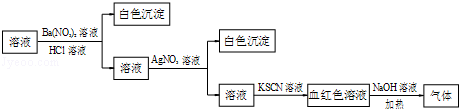
A.原溶液中一定含有SO42﹣离子
B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl﹣离子
D.原溶液中一定含有Fe3+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的检验,分离和提纯方法,不正确的是( )
A. 用分液漏斗分离CCl4与水 B. 用AgNO3溶液检验氯化钠中的Cl-
C. 用浓硫酸干燥CO2 D. 用蒸馏水区别酒精与苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列有关装置先制取干燥、纯净的氯气,后进行有关性质实验。试回答下列问题。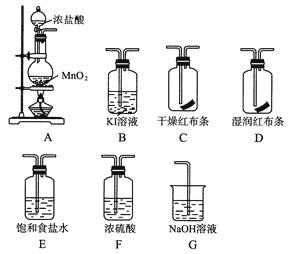
(1)上述装置中各仪器从左至右的连接顺序为接接接接接接。
(2)E装置的作用是 , G装置的作用是 , D中的现象为 , B中的现象为。
(3)写出下列反应的离子方程式:B中 , G中。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com