
分析 (1)根据n=$\frac{m}{M}$计算分子中C、H原子数目之比,进而确定实验式;
(2)根据M=ρVm确定该烃摩尔质量,结合实验式确定分子式.
解答 解:(1)气态烃含C 85.7%,含H 14.3%,则分子中N(C):N(H)=$\frac{85.7%}{12}$:$\frac{14.3%}{1}$=1:2,则该气态烃的实验式为CH2,
答:该烃的实验式CH2;
(2)气态烃在标准状况下的密度是2.5g/L,则其摩尔质量=2.5g/L×22.4L/mol=56g/mol,设分子式为(CH2)x,则14x=56,解得x=4,故该烃的分子式为C4H8,
答:该烃的分子式C4H8.
点评 本题考查有机物分子式的确定,题目难度不大,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:填空题
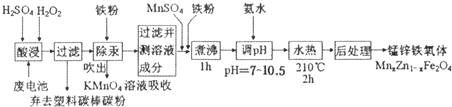
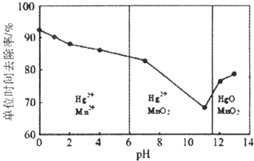
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{8b-3a}{2v}$mol/L | B. | $\frac{8b-3a}{4v}$mol/L | C. | $\frac{8b-3a}{v}$mol/L | D. | $\frac{a-2b}{2v}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向偏铝酸钠溶液中滴加碳酸氢钠溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | |
| B. | Fe(NO3)3溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| C. | 酸性KMnO4溶液与H2O2反应证明H2O2具有还原性:MnO4-+10H++H2O2═2Mn2++6H2O | |
| D. | 澄清的石灰水中加入过量的NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 可简写为
可简写为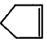 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为: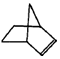
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
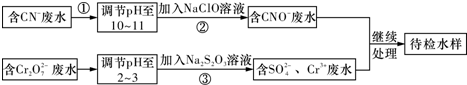
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com