
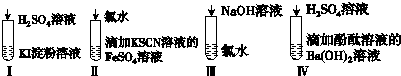
| 选项 | 现象 | 离子方程式 |
| A | I在空气中放置一段时间后,溶液呈蓝色 | 4I-+O2+2H2O═2I2+4OH- |
| B | II溶液由浅绿色变为红色 | Fe2++Cl2═Fe3++2Cl- Fe3++3SCN-═Fe(SCN)3 |
| C | III溶液 颜色无变化 | Cl2+2OH-═Cl-+ClO-+H2O |
| D | IV有白色沉淀生成,溶液由红色变无色 | Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酸性条件下,离子方程式的产物中不会存在氢氧根离子;
B.亚铁离子与氯气反应的离子方程式不满足电荷守恒;
C.氯水为黄绿色,反应后变为无色;
D.硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,溶液由碱性变为中性或酸性.
解答 解:A.稀硫酸加到KI淀粉溶液中,碘离子被氧化成碘单质,在的离子反应为:4H++4I-+O2═2I2+2H2O,故A错误;
B.离子方程式Fe2++Cl2═Fe3++2Cl-违反了电荷守恒,正确的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故B错误;
C.氢氧化钠溶液滴入氯水中,二者发生反应:Cl2+2OH-═Cl-+ClO-+H2O,氯水从黄绿色变为无色,颜色发生了变化,故C错误;
D.滴有酚酞的氢氧化钡溶液呈红色,滴入硫酸后生成硫酸钡沉淀和水,有沉淀生成,当硫酸与氢氧化钡恰好反应后硫酸过量后,溶液变为无色,反应的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,实验现象及所对应的离子方程式都正确,故D正确;
故选D.
点评 本题考查化学实验方案的评价、离子方程式书写,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,试题侧重考查学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量减小6.5 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据气体的相对分子质量,不可以比较相同状况下气体密度的大小 | |
| B. | 根据甲烷和乙烷的熔点,不能比较二者晶体中的分子间作用力的大小 | |
| C. | 比较同主族金属元素原子半径的大小,可以推断元素的金属性强弱 | |
| D. | 根据液体密度的大小,可以判断液体的挥发性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 已知强酸与强碱在稀溶液里反应的中和热为57.3 kJ•mol-1,则 $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃/30MPa}^{催化剂}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | 已知25℃、101KPa条件下:4Al(s)+3O2(g)═2A12O3(s)△H=-2834.9 kJ•mol-1,4Al(s)+2O3(g)═2A12O3(s)△H=-3119.1 kJ•mol-1,则O2比O3稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m1=m2 | B. | m1>m2 | C. | m1<m2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4ab}{a{N}_{A}}$ | B. | $\frac{22.4ac}{b{N}_{A}}$ | C. | $\frac{22.4bc}{a{N}_{A}}$ | D. | $\frac{22.4b}{ac{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com