
【题目】联氨(又称联肼,N2H4 , 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为 , 其中氮的化合价为
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的离子方程式为_.
(3)①2O2(g)+N2(g)=N2O4(l)△H1
②N2(g)+2H2(g)=N2H4(l)△H2
③O2(g)+2H2(g)=2H2O(g)△H3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H4
上述反应热效应之间的关系式为△H4=(用△H1、△H2、△H3表示).
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为(已知:N2H4+H+N2H5+ K=8.5×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为 .
【答案】
(1)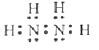 ;-2
;-2
(2)ClO﹣+2NH3=N2H4+Cl﹣+H2O
(3)2△H3﹣2△H2﹣△H1
(4)8.5×10﹣7;N2H6(HSO4)2
【解析】解:(1)肼的分子式为N2H4 , 是氮原子和氢原子形成四个共价键,氮原子和氮原子之间形成一个共价键形成的共价化合物,电子式为 ![]() ;其中氢元素化合价为+1价,则氮元素化合价为﹣2价;
;其中氢元素化合价为+1价,则氮元素化合价为﹣2价;
所以答案是额: ![]() ;﹣2;(2)(2)氨气被次氯酸钠溶液氧化生成肼,次氯酸钠被还原生成氯化钠,结合原子守恒配平书写反应的化学方程式为:ClO﹣+2NH3=N2H4+Cl﹣+H2O;
;﹣2;(2)(2)氨气被次氯酸钠溶液氧化生成肼,次氯酸钠被还原生成氯化钠,结合原子守恒配平书写反应的化学方程式为:ClO﹣+2NH3=N2H4+Cl﹣+H2O;
所以答案是:ClO﹣+2NH3=N2H4+Cl﹣+H2O;(3)已知:①2O2(g)+N2(g)═N2O4(l)△H1②N2(g)+2H2(g)═N2H4(l)△H2③O2(g)+2H2(g)═2H2O(g)△H3
依据盖斯定律计算③×2﹣②×2﹣①得到④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=2△H3﹣2△H2﹣△H1;
所以答案是:△H4=2△H3﹣2△H2﹣△H1;(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离方程式为N2H4+H2ON2H5++OH﹣ , 平衡常数Kb= ![]() =
= ![]() ×
× ![]() =K×Kw=8.7×107×1.0×10﹣14=8.7×10﹣7 , 第二步电离方程式为N2H5++H2ON2H62++OH﹣ , 因此联氨与硫酸形成的酸式盐为N2H6(HSO4)2;
=K×Kw=8.7×107×1.0×10﹣14=8.7×10﹣7 , 第二步电离方程式为N2H5++H2ON2H62++OH﹣ , 因此联氨与硫酸形成的酸式盐为N2H6(HSO4)2;
所以答案是:8.5×10﹣7;N2H6(HSO4)2 .
【考点精析】本题主要考查了反应热和焓变和弱电解质在水溶液中的电离平衡的相关知识点,需要掌握在化学反应中放出或吸收的热量,通常叫反应热;当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】某元素原子价电子排布式为3d54s2,下列说法错误的是( )
A.该元素位于周期表第四周期ⅦB族B.该元素的最高化合价为+7价
C.该元素的化合物常用作催化剂D.该元素位于周期表ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是
A.当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B.当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C.当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D.当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 容量瓶未干燥就直接加水定容
B. 在容量瓶中进行定容时仰视刻度线
C. 称量的NaOH固体已潮解
D. 定容后把容量瓶倒转摇匀,发现液面低于刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中,不符合生产实际的是( )
A.在镀件上电镀锌,用锌作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制氯气,用涂镍碳钢网作阴极
D.电解熔融的氧化铝制取金属铝,用铁作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生产和生活中,金属材料几乎无处不在.
(1)金属的用途和性质紧密相关.已知金属的物理性质有①导热性、②导电性、③还原性、④延展性.请在下面金属用途后填上金属性质对应的序号.
金属的用途 | 对应的金属物理性质 |
用铝定制成包装用的铝箔 | |
用铁、铝等做炊具 | |
用铜与氯化铁溶液反应制作印刷电路 | |
电信业中大量使用的铜丝、金属电缆 |
(2)铝是一种活泼金属,具有较强的还原性.
①金属铝在高温下与三氧化二铁反应,2Al+Fe2O3![]() Al2O3+2Fe,称为铝热反应.试用双线桥法表示电子转移情况 :2Al+Fe2O3
Al2O3+2Fe,称为铝热反应.试用双线桥法表示电子转移情况 :2Al+Fe2O3![]() Al2O3+2Fe,该反应中 是氧化剂(填写化学式), 是还原剂(填写化学式)。反应中生成1mol Fe时,转移 mol电子。
Al2O3+2Fe,该反应中 是氧化剂(填写化学式), 是还原剂(填写化学式)。反应中生成1mol Fe时,转移 mol电子。
②常温时,能用铝制容器盛装的试剂有 (填序号)
A.浓硫酸 B.稀硫酸 C.浓硝酸 D.稀硝酸
③能否用铝制容器盛装NaOH溶液? (填“能”或“不能”),用化学方程式解释: 。
(3)钠是种重要的金属.请回答:将一小块金属钠投入水中,发生反应的化学方程式为 ;可观察到的实验现象是 (填字母)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)3.01×1023个H2O的物质的量为________mol,其中,所有原子的物质的量为________mol,所含电子的物质的量为________mol。
(3)1.204×1023个![]() 的物质的量为________mol,质量为________g。
的物质的量为________mol,质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硅是良好的半导体材料,常用于制造光导纤维
B.高炉炼铁原料有铁矿石、黏土、空气和石灰石
C.制备水泥和玻璃的主要原料都有石灰石
D.煤在空气中加强热得到焦炭、煤焦油、焦炉气、粗氨水等产品的过程叫做煤的干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl﹣、SO42﹣、Br﹣、CO32﹣HCO3﹣等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
(1)火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示: 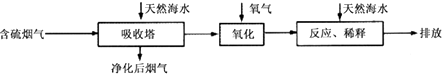
(i)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因 .
(ii)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(iii)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=(用含硫微粒浓度的代数式表示).
(iv)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为 , 所得溶液中c(H+)﹣c(OH﹣)=(填字母编号).
A.c(SO32﹣)﹣c(H2SO3) B.c(SO32﹣)+c(NH3 . H2O)﹣c(H2SO3)
C.c(HSO3﹣)+c(SO32﹣)﹣c(NH4+) D.c(HSO3﹣)+2c(SO32﹣)﹣c(NH4+)
(2)重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10﹣17 | 5.6×10﹣8 | 6.3×10﹣50 | 7.1×10﹣9 | 1.2×10﹣15 | 3.4×10﹣28 |
(i)你认为往废水中投入(填字母序号),沉淀效果最好.
A.NaOH B.Na2S C.KI D.Ca(OH)2
(ii)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= .
(iii)如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1gmL﹣1).若环境要求排放标准为c(Ag+)低于1.0×10﹣8mol/L,问该工厂处理后的废水中c(Ag+)= . (已知KSP(AgCl)=1.8×10﹣10)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com