
| A. | 金刚石 | B. | 石墨 | C. | 铜 | D. | 铁 |
科目:高中化学 来源: 题型:解答题
| 化学键 | O=O | C-O | O-H | C-H |
| 键能(kJ•mol-1) | 498 | 351 | 465 | 413 |
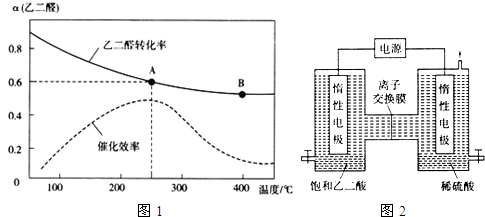
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
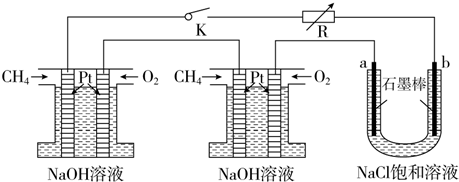
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 东晋葛洪《肘后备急方》一书中记载:“青蒿一握,以水二升渍,绞取汁,尽服之”. 屠呦呦团队在世界率先确定了青蒿素结构式如图所示.下列说法错误的是
东晋葛洪《肘后备急方》一书中记载:“青蒿一握,以水二升渍,绞取汁,尽服之”. 屠呦呦团队在世界率先确定了青蒿素结构式如图所示.下列说法错误的是| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿乃中药,宜采取水煎煮熬汁的方法服用 | |
| C. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取 | |
| D. | 青蒿素分子中有2种非极性键和3种极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F2在暗处遇H2即爆炸,I2在暗处遇H2几乎不反应 | |
| B. | H2O在4000℃以上开始明显分解,H2S用酒精灯加热即可完全分解 | |
| C. | 氯与钠形成离子键,氯与硅形成共价键 | |
| D. | “NO2球”在冷水中颜色变浅,在热水中颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品包装内常放置具有吸水性的化学药品以保持干燥,如五氧化二磷和硅胶 | |
| B. | 青蒿素在超临界CO2中有很强的溶解性,萃取青蒿素可用超临界CO2作萃取剂 | |
| C. | 利用太阳能电池板发电,不发生化学变化 | |
| D. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,说明溶液中含有K+ | |
| B. | 向某无色溶液中滴加BaCl2溶液有白色沉淀出现,说明该溶液中一定含有SO42- | |
| C. | 向某溶液中加AgNO3溶液和稀盐酸,有白色沉淀出现,说明该溶液中一定含有Cl- | |
| D. | 向某溶液中加NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,说明该溶液中一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发氢能替代化石燃料 | |
| B. | 工业含氮废水经处理达标后排放 | |
| C. | 农作物秸秆等露天焚烧制肥料 | |
| D. | 金属、塑料、玻璃、纸类等制品应分类回收处理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com