
| A. | BeCl2 | B. | BF3 | C. | PCl5 | D. | CCl4 |
分析 根据原子最外层电子数和化合价判断,在化合物中,原子最外层电子数等于原子的价层电子数+|化合价|,以此进行分析.
解答 解:A.BeCl2中,Be原子的最外层电子为:2+2=4,Cl原子的最外层电子为:7+|-1|=8,不都满足8电子稳定结构,故A错误;
B.BF3中,B原子的最外层电子为:3+|+3|=6,F原子的最外层电子为:7+|-1|=8,不都满足8电子稳定结构,故B错误;
C.PCl5中,P原子的最外层电子为:5+5=10,Cl原子的最外层电子为:7+|-1|=8,不都满足8电子稳定结构,故C错误;
D.CCl4中C元素化合价为+4,C原子最外层电子数为4,所以4+4=8,C原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故D正确;
故选D.
点评 本题考查原子的结构,本题中注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答,明确所有原子都满足最外层8电子结构是解答的关键.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
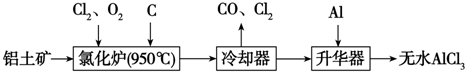
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
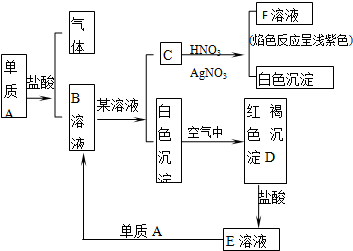
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
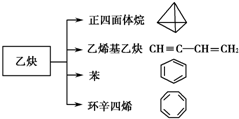 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物. .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个--CH3,能生成4种一氯代物 | B. | 3个--CH3,能生成4种一氯代物 | ||
| C. | 3个--CH3,能生成5种一氯代物 | D. | 2个--CH3,能生成4种一氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}SO_{4}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| B. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}CO_{3}溶液}$$\stackrel{过滤}{→}$滤液$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| C. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}CO_{3}溶液}$$\stackrel{过滤}{→}$滤液$→_{足量}^{HNO_{3}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| D. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}SO_{4}溶液}$$\stackrel{过滤}{→}$滤液$→_{足量}^{HNO_{3}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
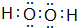 .写出甲的一种用途作高能燃料.
.写出甲的一种用途作高能燃料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com