
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 1.9 | 4.7 | 3.4 |
| 沉淀完全的pH | 3.2 | 6.7 | 4.7 |
| A. | 该温度下Ksp[Fe(OH)3]=1×10-14.6 | |
| B. | W主要含有 Cu(OH)2和Al(OH)3 | |
| C. | 溶液X中一定含有Cu2+、Fe3+和SO42- | |
| D. | 取溶液Y进行焰色反应,可判断溶液X中是否含有Na+ |
分析 取少量待测液滴加KSCN溶液,溶液变红,则X中一定含Fe3+;另取少量待测滴加NaOH溶液至pH=4后过滤,结合表格数据可知分离出Fe(OH)3,向滤液中继续滴加NaOH溶液至过量时又得到沉淀W和溶液Y,W为Cu(OH)2,则X中一定含Cu2+,不能存在CO32-,结合电荷守恒可知,一定含阴离子为SO42-,则Y中含NaOH、Na2SO4,不能确定X中是否含Na+,以此来解答.
解答 解:A.由表格数据可知,铁离子完全沉淀的pH为3.2,则该温度下Ksp[Fe(OH)3]=(1×10-5)×(10-10.8)3=1×10-37.4,故A错误;
B.氢氧化铝能溶于过量的NaOH中,则W主要含有 Cu(OH)2,故B错误;
C.由上述分析可知,溶液X中一定含有Cu2+、Fe3+和SO42-,故C正确;
D.加NaOH引入钠离子,取溶液Y进行焰色反应,不能判断溶液X中是否含有Na+,故D错误;
故选C.
点评 本题考查无机物的推断,为高频考点,把握表中Ksp的应用、氢氧化铝的两性、电荷守恒为解答的关键,侧重分析与推断能力的考查,注意钠离子的判断为易错点,题目难度不大.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Cl>Br | B. | 酸性:H2SO3>H2CO3 | ||
| C. | 碱性:KOH>NaOH | D. | 热稳定性:NH3>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L该溶液中含KNO3101g | |
| B. | 100 mL该溶液中含KNO3 0.01mol | |
| C. | 从1L该溶液中取出500 mL后,剩余溶液的浓度为0.05 mol/L | |
| D. | 1L水中溶解0.1 mol KNO3,即可配得0.1 mol/L KNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
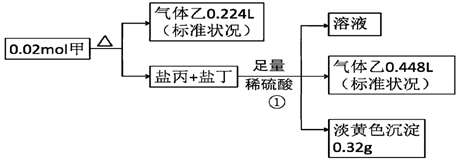
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
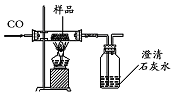 某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相 关 信 息 |
| A | 原子核外有7种运动状态不同的电子 |
| B | 外围电子排布式为nsnnpn+2 |
| C | 常见的金属,在周期表中周期序数与族序数相等 |
| D | 气态氢化物及最高价氧化物对应的水化物均为强酸 |
| E | 一种核素的质量数为56,中子数为30 |
| F | 单质紫红色,电缆材料,常见氧化物为黑色 |
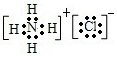
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?CO32-+H3O+ | B. | HCO3-+OH-?CO32-+H2O | ||
| C. | HCO3-+H2O?H2CO3+OH- | D. | S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
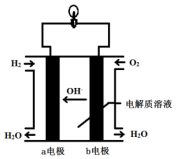 英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图.
英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com