
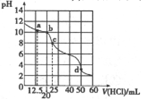
 室温下,用0.1000mol/L盐酸滴定25mL0.1000mol/LNa2A溶液(已知H2A为二元弱酸),其滴定曲线如图所示,下列对滴定中所得溶液的相关离子浓度关系判断正确的是( )
室温下,用0.1000mol/L盐酸滴定25mL0.1000mol/LNa2A溶液(已知H2A为二元弱酸),其滴定曲线如图所示,下列对滴定中所得溶液的相关离子浓度关系判断正确的是( )| A. | a点:c(A2-)=c(HA-) | B. | b点:5c(Cl-)=4[c(A2-)+c(HA-)+c(H2A)] | ||
| C. | c点:c(Na+)>c(HA-)>c(A2-)>c(H2A) | D. | d点:c(H+)=c(HA-)+c(A2-)+c(OH-) |
分析 A.a点时n(HCl)=0.1mol/L×0.0125L=0.00125mol,反应生成0.00125molNaHA,剩余0.00125molNa2A,从盐类的水解程度的角度分析;
B.溶液中存在物料守恒,从物料守恒的角度分析;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHA;
D.溶液中满足电荷守恒,根据电荷守恒的角度分析.
解答 解:A.a点时n(HCl)=0.1mol/L×0.0125L=0.00125mol,反应生成0.00125molNaHA,剩余0.00125molNa2A,由于水解程度大于电离程度,则c(HA-)>c(A2-),故A错误;
B.b点时n(HCl)=0.1mol/L×0.02L=0.002mol,由物料守恒可知:5c(Cl-)=4c(HA-)+4c(A2-)+4c(H2A),故B正确;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHA,溶液呈碱性,所以HA-的电离程度小于水解程度,则有c(A2-)<c(H2A),故C错误;
D.d点时加入盐酸0.005mol,溶液存在电荷守恒,存在c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)+c(Cl-),由于c(Na+)=c(Cl-),则 c(H+)=c(HA-)+2c(A2-)+c(OH-),故D错误;
故选B.
点评 本题综合考查离子浓度的大小比较,题目难度较大,本题注意分析反应物的物质的量之间的关系,判断反应的程度以及溶液的主要成分,结合盐类水解的原理解答.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②④ | C. | ②④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 香柠檬醚分子式为C13H9O4 | |
| B. | 香柠檬醚最多可与7 mol H2发生加成反应 | |
| C. | 1 mol香柠檬酚最多可与2 mol Br2发生反应 | |
| D. | 1 mol香柠檬酚与NaOH溶液反应,最多消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
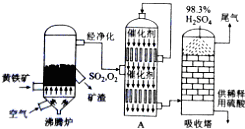
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用明矾净化水 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 用装有硅胶的透气小袋防潮 | |
| D. | 屠呦呦用乙醚从中药中萃取青蒿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H、C、N、O、Na、Fe、Cu是常见的七种元素,请回答下列问题:
H、C、N、O、Na、Fe、Cu是常见的七种元素,请回答下列问题: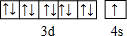 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:a>d>c | |
| B. | 简单离子的半径:c>d>a>b | |
| C. | a、b、c简单离子都会破坏水的电离平衡 | |
| D. | a、b、d的最高价氧化物对应的水化合物两两皆能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $→_{Zn/H_{2}O}^{O_{3}}$
$→_{Zn/H_{2}O}^{O_{3}}$ +
+
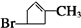 、E
、E .
.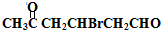 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$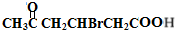 +Cu2O↓+2H2O.
+Cu2O↓+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y2分子中,σ键和π键数目之比为2:1 | |
| B. | Z单质与W单质发生反应,产物只有一种 | |
| C. | 元素X、Z形成的化合物中仅含极性共价键 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com