
| A、等于7.8% |
| B、大于8% |
| C、等于 8% |
| D、小于 7.8% |
| m |
| M |
| 4.6g |
| 23g/mol |
| m溶质 |
| m溶液 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
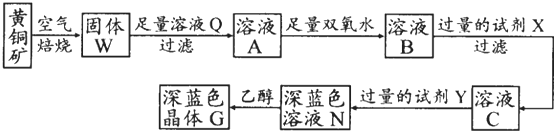
| Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | |
| Ksp | 8.0×1016 | 2.2×1022 | 4.0×1038 |
| 完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
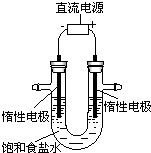 电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集Cl2小于2 L,原因是
电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集Cl2小于2 L,原因是查看答案和解析>>
科目:高中化学 来源: 题型:
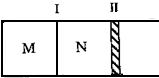 如图所示,隔板I固定不动,活塞II可自由移动.M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g);△H<0.若起始时,M、N容积相同.下列说法正确的是( )
如图所示,隔板I固定不动,活塞II可自由移动.M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g);△H<0.若起始时,M、N容积相同.下列说法正确的是( )| A、起始时,分别向M、N两个容器中加入1molA、1molB,达平衡时,容器M、N中物质A的体积分数相同 |
| B、起始时,分别向M、N两个容器中加入1molA、3molB,达平衡时,容器M中物质A的转化率较大 |
| C、起始时,分别向M、N两个容器中加入2molC,容器N达到平衡所需的时间较短 |
| D、起始时,分别向M、N两个容器中加入1molA、3molB,达到平衡时,容器M中气体的密度较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
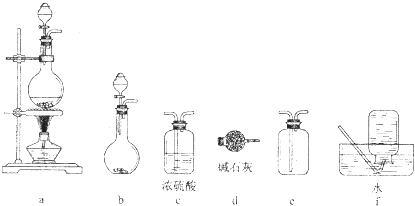
| A、制备收集C2H4:连接a→d→f |
| B、制备收集NO2:连接a→c→f |
| C、制备收集Cl2:连接a→d→e |
| D、制备收集NH3:连接b→→e |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉的分子式是C6H12O6 |
| B、淀粉可以发生银镜反应 |
| C、淀粉可以直接检验食盐中是否含有碘元素 |
| D、淀粉是天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、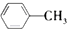 +Cl2 +Cl2
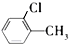 +HCl +HCl | |||
B、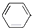 +CH2═CH-CH3 +CH2═CH-CH3
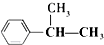 | |||
C、ClCH2CH2CH3+NaOH
| |||
D、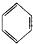 +2HONO2 +2HONO2
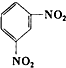 +2H2O +2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com