
【题目】“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料粒子,如将“材料粒子”分散到水中,对所得混合物叙述正确的是( )
A. 能全部透过滤纸 B. 不能发生丁达尔现象
C. 一定是胶状的 D. 可以看见材料粒子
科目:高中化学 来源: 题型:
【题目】常温下,将0.1 mol/LNaOH溶液分别滴加到0.1 mol/LHA溶液和HB溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,回答下列问题:

(1)请计算出Ka(HA) =_____,Ka(HB)_____ Ka(HA) (填“大于' “等于”或“小于”)。
(2)等浓度的HA和HB溶液,若要向其中之一加水让二者pH值相等,应该向_____中加水。
(3)若分别向等浓度等体积的HA和HB溶液中加入NaOH固体让二溶液都呈中性,则 ______需要的NaOH多。
(4)a点溶液中,水电离出的c(H+)=_______。b点溶液中,c(B-)____ c(Na+)(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)不能作为达到平衡状态的依据的是
2NH3(g)不能作为达到平衡状态的依据的是
A. N2,H2和NH3的质量分数不再改变
B. c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C. 断开1 mol H-H的同时形成1 mol H-H
D. 单位时间里每增加1 mol N2,同时消耗3 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )

A. 由图a可知,T1>T2,该反应的逆反应为吸热反应
B. 由图b可知,该反应m+n<p
C. 图c是绝热条件下速率和时间的图像,由此说明该反应吸热
D. 图d中,若m+n=p,则曲线a一定增大了压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl据此,某学生设计了下列实验。
【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3

(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_______________;Ⅱ中玻璃管a的作用为____________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________________
【制取水合肼】实验装置如上图图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式____________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol·L-1的I2溶液滴定。已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为____________;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).FeCl3是中学实验室常用的试剂,可以用来制备氢氧化铁胶体。
下列制备氢氧化铁胶体的操作方法正确的是____________(填字母);
A.向饱和氯化铁溶液中滴加少量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至液体呈红褐色。
(2)写出Ba(OH)2溶液与少量NaHCO3溶液反应的离子方程式:___________________。
(3)写出次氯酸的电子式:________________;写出过氧化钠中存在的所有化学键类型:____________________。
(4)铁粉中含有铝粉,可加______除去杂质,发生的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示,反应的热化学方程式为____________________________________________。
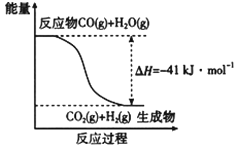
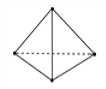
(2)意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,1mol N4生成N2的ΔH=_________ kJ·mol-1
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。298K时,已知:
①C(s,石墨)+O2(g)![]() CO2(g) ΔH1=a kJ·mol-1
CO2(g) ΔH1=a kJ·mol-1
②2H2(g)+O2(g)![]() 2H2O(l) ΔH2=b kJ·mol-1
2H2O(l) ΔH2=b kJ·mol-1
③2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH3=c kJ·mol-1
4CO2(g)+2H2O(l) ΔH3=c kJ·mol-1
则反应:2C(s,石墨)+H2(g)![]() C2H2(g) 的焓变ΔH=__________(用含a、b、c的式子表示)。
C2H2(g) 的焓变ΔH=__________(用含a、b、c的式子表示)。
(4)已知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g)![]() 2Al2O3(s) ΔH1
2Al2O3(s) ΔH1
4Fe(s)+3O2(g)![]() 2Fe2O3(s) ΔH2
2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是____________
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是

A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com