
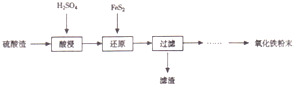
 (填试剂)检验滤液中含有Fe3+.“酸浸”后Fe3+可被空气中O2氧化(用离子反应方程式表示)4Fe2++O2+4H+=4Fe3++2H2O
(填试剂)检验滤液中含有Fe3+.“酸浸”后Fe3+可被空气中O2氧化(用离子反应方程式表示)4Fe2++O2+4H+=4Fe3++2H2O| 沉淀物 | Fe(OH)3 | A1(0H)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
分析 (1)酸浸”中硫酸要适当过量,抑制Fe3+的水解;
(2)由信息Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,在利用氧化还原反应配平方程式:
(3)①若SnCl2不足量,Fe3+没有完全还原为Fe2+,则测定的Fe3+量偏低;
②若不加HgCl2,溶液中含有Sn2+,也可以被酸性高锰酸钾氧化,消耗的酸性高锰酸钾氧化偏大,则测定的Fe3+量偏高.
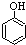
(4)①检验滤液中含有Fe3+是KSCN溶液;Fe2+的氧化反应是被氧气氧化为铁离子;
②第一步.向溶液中加入过量的酸性高锰酸钾溶液,搅拌;第二步.滴加NaOH溶液,调节溶液的pH为3.2~3.8,使Fe3+完全沉淀.
解答 解:(1)Fe3+的水解方程式为Fe3++3H2O?Fe(OH)3+3H+,酸过量,提高铁的浸出率,抑制Fe3+的水解;
故答案为:抑制Fe3+的水解;
(2)根据题给信息,写出反应物和生成物,因为在酸性环境下反应,则介质为H2O和H+,根据电子得失守恒和离子所带电荷守恒可以写出离子方程式为:14Fe3++FeS2+8H2O=15Fe2++2SO42-+16H+;
故答案为:14Fe3++FeS2+8H2O=15Fe2++2SO42-+16H+;
(3)①SnCl2不足,Fe3+没有完全反应,生成的Fe2+偏少,则消耗的K2Cr2O7标准溶液体积偏小,则测定的Fe3+量偏低;
故答案为:偏低;
②若不加HgCl2,过量的Sn2+也能够被K2Cr2O7氧化,则消耗的K2Cr2O7标准溶液体积偏高,则测定的Fe3+量偏高;
故答案为:偏高;
(4)①Fe3+与KSCN的络合反应或者Fe3+与酚羟基的显色反应均可以用于鉴别.产生Fe3+的原因是Fe2+被空气中的氧气氧化,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O;
故答案为:KSCN或 ,4Fe2++O2+4H+=4Fe3++2H2O;
,4Fe2++O2+4H+=4Fe3++2H2O;
②“过滤”后的溶液中有Fe2+、Al3+、Mg2+以及少量Fe3+,首先向溶液中加入过量的酸性高锰酸钾溶液,搅拌,将Fe2+完全氧化为Fe3+,然后控制pH,只使Fe(OH)3沉淀,从表格数据可以分析,控制pH为3.2~3.8.
故答案为:向溶液中加入过量的酸性高锰酸钾溶液,搅拌;滴加NaOH溶液,调节溶液为pH为3.2~3.8;
点评 本题考查了物质制备和实验探究方法,物质性质和制备原理的理解应用,实验方案设计,物质分离的方法应用,掌握基础是关键,题目难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20种 | B. | 16种 | C. | 10种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
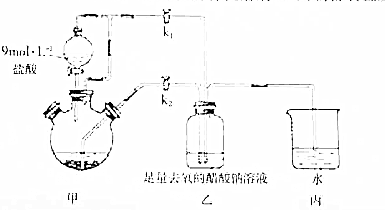 ①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液.
①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;D的核磁共振氢谱共有3组峰.
;D的核磁共振氢谱共有3组峰.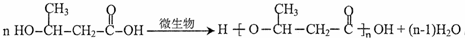 .
. 的合成路线图为
的合成路线图为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
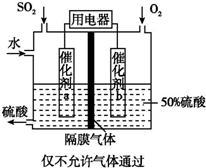 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
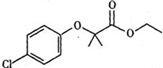 )是临床一种应用广泛的药物,它的一条合成路线如图:
)是临床一种应用广泛的药物,它的一条合成路线如图: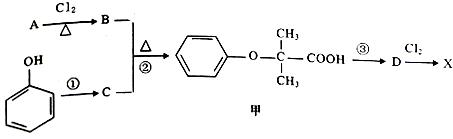
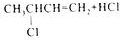
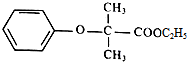 .
.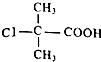 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$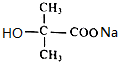 +NaCl+H2O.
+NaCl+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com