
| A. | 邻二甲苯属于芳香烃,它的官能团是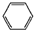 | |
| B. | 分子结构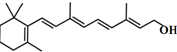 是维生素A的键线式 是维生素A的键线式 | |
| C. | 氯溴碘代甲烷的同分异构体数目有两个,就像人的左右手似的 | |
| D. | 乙醇与二甲醚互为同分异构体,这种同分异构现象叫官能团异构 |
分析 A. 不是官能团;
不是官能团;
B.只用键线来表示碳架,两根单键之间或一根双键和一根单键之间的夹角为120?,一根单键和一根三键之间的夹角为180?,而分子中的碳氢键、碳原子及与碳原子相连的氢原子均省略,而其他杂原子及与杂原子相连的氢原子须保留,每个端点和拐角处都代表一个碳,用这种方式表示的结构式为键线式;
C.氯溴碘代甲烷是手性分子,存在镜像异构;
D.乙醇(CH3CH2OH)和二甲醚(CH3-O-CH3)分子式相同,结构不同,互为同分异构体,二者官能团不同;
解答 解:A.邻二甲苯(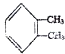 )属于芳香烃,没有官能团,故A错误;
)属于芳香烃,没有官能团,故A错误;
B.用键线式表示维生素A的分子结构 ,故B正确;
,故B正确;
C.氯溴碘代甲烷是手性分子,存在镜像异构,就像人的左右手似的,故C正确;
D.乙醇(CH3CH2OH)和二甲醚(CH3-O-CH3)分子式相同,结构不同,互为同分异构体,二者官能团不同,属于官能团异构,故D正确;
故选A.
点评 本题主要考查同分异构现象、键线式、官能团等,题目难度不大,注意同分异构体的种类.


科目:高中化学 来源: 题型:选择题
| A. | 合金都只是由两种或多种金属熔合而成的 | |
| B. | 青铜、黄铜、白铜都是合金 | |
| C. | 合金属于纯净物 | |
| D. | 钢不属于合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
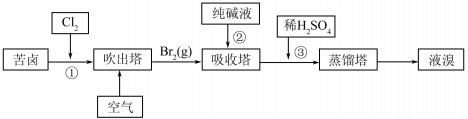
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++CO32- | |
| B. | 过量的CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O═HCO3-+HClO | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+═CO2↑+H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2CO3溶液:c(Na+)+c(H+)=c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(OH-) | |
| C. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O${\;}_{4}^{-}$)+2c(H2C2O4) | |
| D. | CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该条件下,钠的还原性强于C | |
| B. | 若CO2过量,则有Na2CO3生成 | |
| C. | 该反应中化学能除转化为热能外,还转化为电能 | |
| D. | Na2O是离子化合物,其中离子半径:r(Na+)>r(O2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 标准状况下,22.4L 氖气含有的氖原子数为2 NA | |
| C. | 常温常压下,22.4L CO2气体含有的分子数为NA | |
| D. | 在1L的0.5mol•/L的MgCl2溶液中,含Cl- 数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
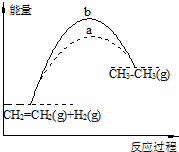
| A. | 图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 | |
| B. | 己知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 | |
| C. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
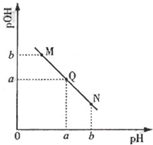 已知:25℃时,CH3COOH和NH3•H2O的电离常数相等.
已知:25℃时,CH3COOH和NH3•H2O的电离常数相等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com