
| A. | 由紫色变为无色 | B. | 颜色无明显变化 | C. | 先褪色,后复原 | D. | 由紫色变为红色 |
分析 氯气、二氧化硫通入水溶液中时,二者等物质的量通入石蕊试液,发生反应Cl2+SO2+2H2O=2HCl+H2SO4,溶液中生成盐酸和硫酸导致溶液呈酸性,盐酸和硫酸都没有漂白性,据此分析解答.
解答 解:氯气、二氧化硫通入水溶液中时,二者等物质的量通入石蕊试液,发生反应Cl2+SO2+2H2O=2HCl+H2SO4,溶液中生成盐酸和硫酸导致溶液呈酸性,盐酸和硫酸都没有漂白性,石蕊试液遇酸变红色,所以看到的现象是溶液由紫色变红色,故选D.
点评 本题考查二氧化硫、氯气的性质,二氧化硫、次氯酸都具有漂白性,但氯气、二氧化硫以1:1通入溶液时没有漂白性,明确发生的反应是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
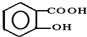 ,请回答下列问题:
,请回答下列问题: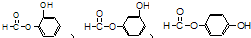 ;
;
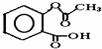 ,1摩尔阿司匹林与NaOH完全反应需要氢氧化钠3mol.
,1摩尔阿司匹林与NaOH完全反应需要氢氧化钠3mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
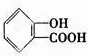 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
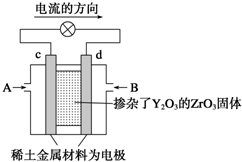
 ,属于离子化合物.
,属于离子化合物. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
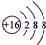
 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如下图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入丙烷和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2-.
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如下图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入丙烷和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 据反应①可知N2的燃烧热为180 kJ•mol-1 | |
| B. | 2H2O(l)═2H2(g)+O2(g)△H>+483.6 kJ•mol-1 | |
| C. | 反应②在恒温恒容密闭容器反应达平衡后,充入N2,平衡正向移动,氮气的转化率减小,该反应的平衡常数增加 | |
| D. | 可推知,氨的催化氧化的热化学方程式为4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-906 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com