
���� ��1������n=$\frac{m}{M}$����������ʵ�����������Ŀ֮�ȵ��������ʵ���֮�ȣ�����Oԭ�ӹ��ɣ�����ԭ��������ȣ�����Oԭ����Ŀ��ȣ�
��2��ͬ��ͬѹ�£�����Ħ�������ȣ���ͬ����IJ�ͬ���������ʵ�����ȣ�����m=nM���������ȣ�
��3��1mol�����к���10mol���ӣ��ݴ˼��㣻
��4���������ʵĹ��ɿ�֪���ʵ����ʵ�����������M=$\frac{m}{n}$����Ħ��������Ħ����������Է�����������ֵ����ȣ��Դ������
��5����Ũ�������ΪVL����16mol/L��VL=4mol/L��0.05L��V=12.5mL��
��6����Ӧ2NO2+4CO=N2+4CO2�У����������Ƕ�����̼������1mol�ĵ���ת�Ƶ���4��2mol�ĵ��ӣ�
��� �⣺��1����O2�����ʵ���Ϊ$\frac{48g}{32g/mol}$=1.5mol��
O3�����ʵ���Ϊ$\frac{48g}{48g/mol}$=1mol��
��O2��O3�������Ӹ�����Ϊ1.5mol��1mol=3��2��
O2��O3����Oԭ�ӹ��ɣ�����ԭ��������ȣ�����Oԭ����Ŀ��ȣ���ԭ�Ӹ���Ϊ1��1���ʴ�Ϊ��3��2��1��1��
��2��ͬ��ͬѹ�£�����Ħ�������ȣ���ͬ����IJ�ͬ���������ʵ�����ȣ������ʵ���Ϊ1mol������������Ϊ64��80=4��5���ʴ�Ϊ��4��5��
��3�����е������ʵ���Ϊ1mol��10=10mol���ʴ�Ϊ��10��
��4��2.3g R2O4����0.1mol��ԭ�ӣ�
��n��R2O4��=$\frac{0.1}{4}$=0.025mol��
����M��R2O4��=$\frac{2.3}{0.025}$=92g/mol��
��Ħ����������Է�����������ֵ����ȣ�
��X�����ԭ������Ϊx����
2x+16��4=92��
���x=14���ʴ�Ϊ��14��
��5����Ũ�������ΪVL����16mol/L��VL=4mol/L��0.05L��V=12.5mL���ʴ�Ϊ��12.5��
��6����Ӧ2NO2+4CO=N2+4CO2�У����������Ƕ�����̼������1mol�ĵ���ת�Ƶ���4��2mol�ĵ��ӣ�����ÿ��14g N2���ɣ���Ӧ��ת�Ƶĵ���Ϊ4mol���ʴ�Ϊ��CO2��4��
���� ���⿼�����ʵ����ļ��㣬Ϊ��Ƶ���㣬����ѧ���ķ��������������Ŀ��飬ע�������ؼ��㹫ʽ�����ã���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�������Ͽ��Ի�ѧ�Ծ��������棩 ���ͣ������
����������N2H4������һ�ֹ�ҵԭ�ϣ�����һ����Ҫ�Ĺ�ҵ��Ʒ��
��1��ʵ���ҿ����Ȼ������ʯ�ҷ�Ӧ��ȡ�������䷴Ӧ�Ļ�ѧ����ʽΪ ��
��2��������һ�������¿ɰ���ʽ�֡�������
3N2H4(g)=N2(g)+4NH3(g)����֪����1molN��H��N��N��N��N�����յ���������Ϊ390.8kJ��193kJ��946kJ��������1molN2����Ӧ ����ų��������ա��� kJ��������
��3��NH3��O2ȼ�ϵ�صĽṹ��ͼ��ʾ��
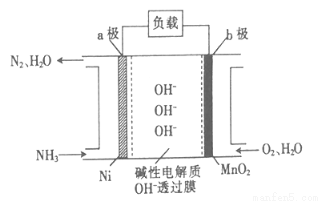
��a��Ϊ��ص� �����������������
�ڵ�����1molN2ʱ����·���������ӵ����ʵ���Ϊ ��
��4���������Ը�Ч���ѳ��̵����е�NO�Ӷ�����N2���÷�Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ɱ�-H2O | B�� | ˮ��-Ag | C�� | �ƾ�-C2H5OH | D�� | ����-NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
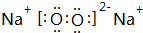
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | z=2 | B�� | 2s�������ڵ�ѹǿ�dz�ʼ��$\frac{7}{8}$�� | ||
| C�� | 2sʱC���������Ϊ$\frac{2}{7}$ | D�� | 2s��B��Ũ��Ϊ0.5mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͨ��CH4�ĵ缫Ϊ���� | |
| B�� | ͨ��CH4�ĵ缫��ӦΪ��CH4+10OH-��CO32-+7H2O+8e- | |
| C�� | ͨ��O2�ĵ缫Ϊ���� | |
| D�� | �ŵ�ʱ��Һ���������������ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��NH4+����c��Cl-����c��OH-����c��H+�� | B�� | c��Cl-����c��NH4+����c��H+����c��OH-�� | ||
| C�� | c��Cl-��=c��NH4+����c��OH-��=c��H+�� | D�� | c��Cl-��=c��NH4+����c��OH-����c��H+�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com