
【题目】一定条件下反应2AB(g) ![]() A2(g)+B2(g)达到平衡状态的标志是 ( )
A2(g)+B2(g)达到平衡状态的标志是 ( )
A. 单位时间内生成nmolA2,同时消耗2n molAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的消耗速率
D. 容器中各组分的体积分数不随时间变化
科目:高中化学 来源: 题型:
【题目】研究发现:一节电池烂在地里,能够使一平方米的土地失去利用价值。废旧电池的危害上要集中在其中所含的少量重金属上。将废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
(1)回收填料中的二氧化锰和氯化铵。已知:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。回收物质的流程如图所示。
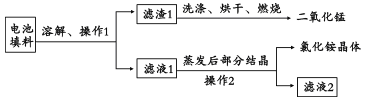
① 操作中先将电池填料研碎的目的是:________________。
② 操作l和操作2的名称都是___________,该操作中玻璃棒的作用是___________。
③ 灼烧滤渣l的目的是______________________。
(2)回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。
①写出MnOOH与浓盐酸反应的化学方程式:________________。
② 锰回收新方法:向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的化学方程式______________。与使用浓盐酸回收锰相比,新方法的优点是___________(答l点即可)。
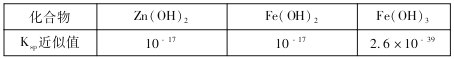
(3)用废电池的锌皮可用于回收制作ZnSO4·7H2O。过程中,需除去锌皮中的少量杂质铁,其方法是:常温下,加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=_________。继续加碱调节pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。部分难溶的电解质溶度积常数(Ksp)如下表:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及化合物(或溶液)的转化关系:
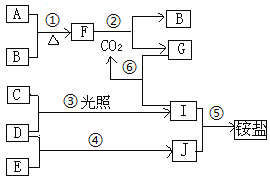
已知B、C、D、E是非金属单质,且在常温下都是气体;化合物G的焰色反应为黄色,化合物I、J通常状况下呈气态;反应④是化工生产中的一种重要固氮反应。请回答下列问题:
(1)写出A、B元素在周期表中的位置:A__________________ B__________________
(2)①~⑥反应中属于氧化还原反应的是 ___________________________________(填序号)
(3)写出②的化学方程式: _____________________________
⑥的离子方程式:______________________________________
(4)反应⑤的现象是________,J的另一种检验方法及现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
温度(T) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
从上表可推断,反应①是________(填“放”或“吸”)热反应。
(2)现有反应③H2(g)+CO2(g)![]() CO(g)+H2O(g) ΔH=Q3的平衡常数为K3
CO(g)+H2O(g) ΔH=Q3的平衡常数为K3
Ⅰ.根据反应①与②推导出Q1、Q2、Q3的关系式Q3=________。根据反应①与②推导出K1、K2、K3的关系式K3=____________;可推断反应③是________(填“放”或“吸”)热反应。
Ⅱ.要使反应③在一定条件下建立的平衡右移,可采取的措施有________。
A.缩小容器体积
B.降低温度
C.使用合适的催化剂
D.设法减少CO的量
E.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入一定量SO2、O2发生反应2SO2(g)+O2(g)![]() 2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是( )
2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是( )

A. 该反应△H>0
B. SO2转化率:a>b>c
C. 化学反应速率:c>b>a
D. 平衡常数K:b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于离子反应下列说法不正确的( )
A.参加离子反应的不一定都是电解质
B.离子反应的实质是反应物离子浓度减少或生成物离子浓度增加
C.离子反应只能在水溶液中进行
D.没有沉淀,气体,水生成的就不是离子反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B. 对2H2O2![]() 2H2O+O2的反应,使用MnO2可加快制O2的反应速率
2H2O+O2的反应,使用MnO2可加快制O2的反应速率
C. 反应CO+NO2![]() CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
D. 合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验式相同,既不是同系物,又不是同分异构体的是( )
A.1-辛烯和3-甲基-1-丁烯 B.苯和乙炔
C.1-氯丙烷和2-氯丙烷 D.甲苯和乙苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向等物质的量浓度的两种一元酸的盐溶液中,分别通入少量的CO2,发生如下反应:NaA+CO2+H2O===HA+NaHCO3 2NaB+CO2+H2O===2HB+Na2CO3,则等物质的量浓度的HA和HB在水中电离出H+的能力大小关系是 ( )
A.HA较强 B.HB较强 C.两者一样 D.无法比较
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com