
| A、溶质的电离方程式为NaHCO3═Na++H++CO32- |
| B、25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 |
| C、离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D、温度升高,c(HCO3-)增大 |


科目:高中化学 来源: 题型:
| A、CnH2n+2O 醇 |
| B、CnH2nO 醛 |
| C、CnH2nO2 酸 |
| D、CnH2n+2 烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
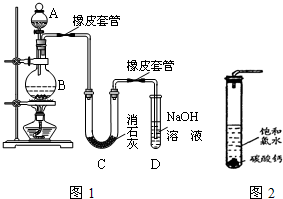
 C和Si元素在化学中占有极其重要的地位.
C和Si元素在化学中占有极其重要的地位.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
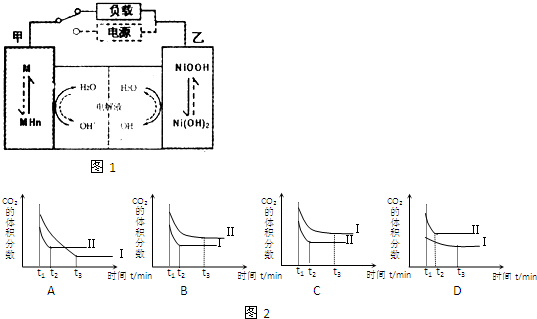
| 放电 |
| 充电 |
| 1 |
| 2 |
| 容器编号 | c(CO)/mol?L-1 | c(O2)/mol?L-1 | c(CO2)/mol?L-1 | v正和v逆比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-4 | v正=v逆 |
| Ⅱ | 1.0×10-3 | 4.0×10-4 | 5.0×10-4 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com