
【题目】下列反应中,氧化剂与还原剂物质的量之比为1:2的是( )
A.3S+6NaOH=2Na2S+Na2SO3+3H2O
B.2CH3COOH+Ca(ClO)2=2HC1O+Ca(CH3COO)2
C.I2+2NaClO=2NaIO3+C12
D.4HCl(浓)+MnO2![]() MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O
【答案】D
【解析】
试题分析:A.在反应3S+6NaOH=2Na2S+Na2SO3 +3H2O中,3molS参加反应,1molS作还原剂,2molS作氧化剂,所以氧化剂与还原剂的物质的量之比为2:1,故A错误;B.在反应2CH3COOH + Ca(ClO)2=2HC1O+Ca(CH3COO)2中,没有元素的化合价的变化,即没有电子转移,不属于氧化还原反应,故B错误;C.在反应I2+2NaClO=2NaIO3+C12中,碘元素化合价升高,I2做还原剂、氯元素化合价降低,NaClO做氧化剂,所以氧化剂与还原剂的物质的量之比为2:1,故C错误;D.在反应4HCl(浓)+MnO2![]() MnCl2+Cl2+2H2O中,当有4molHCl参加反应时,1molMnO2做氧化剂、2molHCl做还原剂,所以氧化剂与还原剂物质的量之比为1:2,故D正确。故选D。
MnCl2+Cl2+2H2O中,当有4molHCl参加反应时,1molMnO2做氧化剂、2molHCl做还原剂,所以氧化剂与还原剂物质的量之比为1:2,故D正确。故选D。


科目:高中化学 来源: 题型:
【题目】在一个容积为2L的密闭容器中,加入0.8molA2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+ B2(g)![]() 2AB(g)ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g)ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
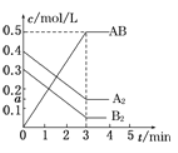
A.图中a点的值为0.15
B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小
D.平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义。
(1)下列措施中,有利于降低大气中的CO2、SO2、NO2浓度的有___________(填字母)。
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)为开发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料。写出由CO和H2生产甲醇的化学方程式________________________,
用该反应合成1 mol液态甲醇吸收热量131.9 kJ。又知2H2(g)+CO(g)+3/2O2(g)==CO2(g)+2H2O(g) ΔH=-594.1 kJ/mol。请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A. XX化妆品从纯天然植物中提取,不含任何化学物质
B. 红宝石、玛瑙、水晶、钻石等制作装饰品的材枓,其物质的主要成份都是硅酸盐
C. 氢氧燃料电池、硅太阳能电池中都利用了原电池原理
D. 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材科
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com