
分析 (1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉钝化;
(2)①利用+2价亚铁离子能使酸化的高锰酸钾褪色来检验;
②生成的SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,利用硫元素的守恒,结合关系式:SO2→BaSO4求出SO2的体积分数;
(3)Al和水不反应,所以剩余金属应该是Al,根据Na和Al之间的关系式及转移电子守恒计算;
(4)固体混合物和稀硫酸反应后有固体剩余,说明溶液中不存在铁离子,向滤液中加入加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,说明硫酸有剩余,铁先和铜离子后和氢离子发生置换反应,所以滤液中的溶质是硫酸、硫酸亚铁,根据硫酸根离子守恒计算硫酸亚铁的物质的量浓度.
解答 解:(1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉钝化阻止反应进一步进行,故答案为:铁表面被钝化;
(2)①金属铁和硫酸之间发生反应,可能会发生的反应有:Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;故答案为:Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;
②SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,
n(混合气体)=$\frac{0.336L}{22.4l/mol}$=0.015mol,
SO2→BaSO4
1mol 233g
n 2.33g
n=0.01mol
则 SO2的体积分数:$\frac{0.01}{0.015}$×100%=66.7%,
故答案为:66.7%.
(3)Al和水不反应,所以剩余金属应该是Al,反应方程式为2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可以得出关系式Na~NaOH~Al,则参与反应的Na和Al的质量之比为23:27,Na和Al的质量和为15g,所以n(Na)=$\frac{\frac{23}{23+27}×15}{23}$mol=0.3mol,n(Al)=$\frac{15×\frac{27}{23+27}}{27}$mol=0.3mol,根据Na、Al和氢气之间的关系式得氢气体积=(0.3mol×0.5+0.3mol×1.5)×22.4L/mol=13.44L,
故答案为:13.44;
(4)固体混合物和稀硫酸反应后有固体剩余,说明溶液中不存在铁离子,向滤液中加入加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,说明硫酸有剩余,铁先和铜离子后和氢离子发生置换反应,所以滤液中的溶质是硫酸、硫酸亚铁,n(H2SO4)=2.2mol/L×0.12L=0.264mol,
与氢氧化钠反应的硫酸的物质的量为:$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×2mol/L×0.04L=0.04mol,剩余的硫酸的物质的量=0.264mol-0.04mol=0.224mol,
剩余硫酸与固体反应生成了硫酸亚铁,根据硫酸和硫酸亚铁的关系式计算硫酸亚铁的物质的量浓度=$\frac{0.224mol}{0.12L}$=1.87mol/L,
故答案为:1.87.
点评 本题综合考查元素化合物知识、提出假设并设计实验方案的能力和文字表达能力,开放性较强,涉及浓硫酸的强氧化性,C、S与Fe及其化合物的性质,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ⑥⑤②①④③ | B. | ⑤⑥②①③④ | C. | ④③②①⑤⑥ | D. | ④③①②⑥⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减少 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C 的体积分数的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
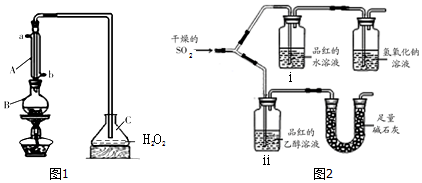
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
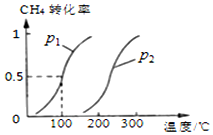 甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料.
甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、S2-、SO42- | B. | Na+、Cu2+、SO42-、Cl- | ||
| C. | Br-、Ba2+、Cl-、K+ | D. | Ca2+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
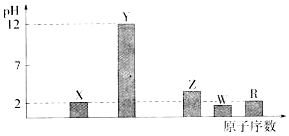
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com