
【题目】硫酸铵是一种传统的氮肥,某种制取硫酸铵的流程如下:
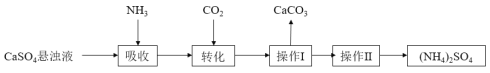
请回答下列问题:
(1)操作Ⅰ的名称为_________。
(2)在CaSO4悬浊液中通入NH3、CO2生成(NH4)2SO4的化学方程式________________。
(3)为测定硫酸铵的纯度,称取3.000g样品,溶于水,依次加入足量稀盐酸和足量BaCl2溶液,充分反应,过滤,沉淀经洗涤后烘干至恒重,得到4.660 g BaSO4。该硫酸铵的纯度为_______________。
【答案】过滤 CaSO4+2NH3+CO2+H2O = CaCO3↓+(NH4)2SO4 88%
【解析】
制取(NH4)2SO4晶体的流程分析可知,硫酸钙悬浊液通入氨气吸收,再通入二氧化碳转化生成碳酸钙和硫酸铵,过滤得到溶液通过蒸发浓缩、冷却结晶、过滤洗涤、干燥得到硫酸铵的晶体,据此解答。
(1)操作Ⅰ为固液分离,其操作名称为过滤;
(2)CaSO4悬浊液中通入NH3,溶液中生成NH3H2O,再通入CO2时,CO2与NH3H2O反应生成![]() ,
,![]() 与溶液中Ca2+反应生成CaCO3,整个过程的化学方程式为:CaSO4+2NH3+CO2+H2O = CaCO3↓+(NH4)2SO4;
与溶液中Ca2+反应生成CaCO3,整个过程的化学方程式为:CaSO4+2NH3+CO2+H2O = CaCO3↓+(NH4)2SO4;
(3)4.660gBaSO4的物质的量为![]() =0.02mol,根据硫酸根离子守恒可知样品中n[(NH4)2SO4]=0.02mol,m[(NH4)2SO4]=0.02mol×132g/mol=2.64g,则硫酸铵的纯度为
=0.02mol,根据硫酸根离子守恒可知样品中n[(NH4)2SO4]=0.02mol,m[(NH4)2SO4]=0.02mol×132g/mol=2.64g,则硫酸铵的纯度为![]() =88%。
=88%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)下列元素或化合物的性质变化顺序正确的是__________________
A.第一电离能:Cl>S>P>Si
B.共价键的极性:HF>HCl>HBr>HI
C.晶格能:NaF>NaCl>NaBr>NaI
D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
(2)FeCl3 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 FeCl3 的结构式为_________,其中 Fe 的配位数为___________________
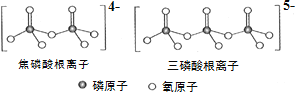
(3)NH4H2PO4 中,电负性最高的元素是________;P的________________杂化轨道与 O的2p轨道形成______键。NH4H2PO4 和 LiFePO4 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐, 如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示。这类磷酸根离子的化学式可用通式表示为 ______________(用 n 代表 P 原子数)。
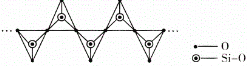
(4)高温高压下 CO2 的晶体结构与SiO2 相似,该晶体熔点比 SiO2 晶体____________(填“高”或“低”)。硅酸盐和 SiO2 一样,都是以硅氧四面体作为基本结构单元,图中表示一种含 n 个硅原子的单链式多硅酸根的结构(投影如图),Si 原子的杂化类型为_______________,其化学通式可表示为____________________
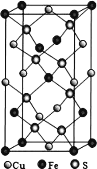
(5)四方晶系 CuFeS2 晶胞结构如图所示(下一页)。Cu2+的配位数为_______________,S2-的配位数为__已知:a=b=0.524 nm,c=1.032 nm,NA 为阿伏加德罗常数的值,CuFeS2晶体的密度是_________________ gcm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水CoCl2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变成无水CoCl2,故常在实验室中用作吸湿剂和空气湿度指示剂。
CoCl2+xH2O![]() CoCl2·xH2O
CoCl2·xH2O
深蓝色 粉红色
现有65 g无水CoCl2,吸水后变成CoCl2·xH2O 119 g。
(1)水合物中x=________。
(2)若该化合物中Co2+配位数为6,而且经定量测定得知内界和外界占有Cl-的个数比为1∶1,则其化学式可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年诺贝尔化学奖授予了在锂离子电池领域作出突出贡献的三位科学家。一类锂离子电池的电池总反应为Lix C6 +Li1-xY![]() C6 (石墨)+LiY 。已知电子电量为1.6 ×10-19 C ,下列关于这类电池的说法中错误的是
C6 (石墨)+LiY 。已知电子电量为1.6 ×10-19 C ,下列关于这类电池的说法中错误的是
A.金属锂的价电子密度约为 13760 C/gB.从能量角度看它们都属于蓄电池
C.在放电时锂元素发生了还原反应D.在充电时锂离子将嵌入石墨电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】费托合成是以合成气(CO 和 H2 混合气体)为原料在催化剂和适当条件下合成烯烃(C2~C4)以及烷烃(CH4、C5~C11、C12~C18 等,用Cn H2n+2 表示)的工艺过程。
已知:① 2CO(g) +O2(g) =2CO2 (g) △H1 =a
②2H2(g) + O2(g)=2H2O(g) △H2 =b
③![]()
回答下列问题:
(1)反应(2n +1)H2 (g)+nCO(g)=CnH2n+2(g)+nH2O(g)的 △H_____。(用含有a、b、c、n 的式子表示)
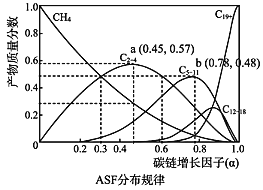
(2)费托合成产物碳原子分布遵循 ASF 分布规律。碳链增长因子(α)是描述产物分布的重要参数,不同数值对应不同的产物分布。ASF 分布规律如图,若要控制 C2~C4 的质量分数 0.48~0.57,则需控制碳链增长因子(α)的范围是________。
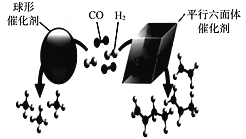
(3)近期,我国中科院上海高等研究院在费托合成烃的催化剂上取得重大进展。如图所示,Co2C作催化剂的规律是:选择球形催化剂时_____,选择平行六面体催化剂时_____。
(4)中科院大连化物所研究团队直接利用CO2 与H2 合成甲醇。一定条件下,向 2L 恒容密闭容器中充入1molCO2和 2mol H2发生反应“CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H”。CO2 的平衡转化率(α)与温度(T)的关系如图所示。
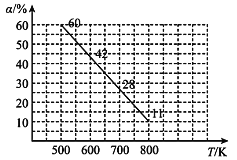
①判断△H_______0。(填“大于”“小于”或“等于”)
②500 K 时,反应 5 min 达到平衡。计算 0~5 min 用H2O 表示该反应的化学反应速率为_________,该反应的平衡常数为__________。
③500 K 时,测定各物质的物质的量浓度分别为 c(CO2)=0.4 mol/L、c(H2) = 0.2 mol/L、c(CH3OH) = 0.6 mol/L、c(H2O) = 0. 6 mol/L,此时反应____ (填“是”或“否”) 达到平衡,理由是_____ 。
④一定条件下,对于反应 CO2(g) + 3H2(g)CH3OH(g) + H2O(g)。下列说法中不能表明反应达到平衡的是_____。
a.恒温恒容下,c(CH3OH)=c(H2O)
b.恒温恒容下,体系的压强保持不变
c.恒温恒容下,体系的平均摩尔质量不变
d.相同时间内,断裂 H-H 键和断裂 H-O 键之比 1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置在铁钥匙上镀铜,下列说法错误的是( )
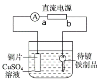
A.铁钥匙作阳极B.a为电源的正极
C.通电后,溶液中SO42-移向阴极D.铜片上的反应式为Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过石油裂解可以获得乙烯,再以乙烯为原料还可以合成很多的化工产品,已知D有香味,试根据如图回答有关问题:
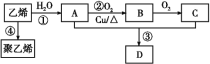
(1)有机物B的名称为____;A、C的官能团名称分别是____和____;聚乙烯的结构简式为_____________。
(2)写出图示中①、②、③反应的化学方程式,并指明反应类型:
①_____;反应类型:______。
②______;反应类型:______。
③_______;反应类型:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z均为短周期元素,X、W可形成两种液态化合物甲和乙,其原子个数比分别为1∶1(甲)和2∶1(乙),且分子中电子总数分别为18(甲)和10(乙)。X与Z能形成一种极易溶于水的碱性气体丙X与Y能形成极易溶于水的酸性气体丁,丁分子中的电子数为18。X、Y、Z能形成一种离子化合物,其水溶液呈弱酸性。请写出:
(1)W的元素符号___,其核外共有___种运动状态不同的电子。
(2)甲物质的结构式为___;乙物质的空间构型为___。
(3)Z元素核外共有___种能量不同的电子,碱性气体甲的电子式为___。
(4)用离子方程式解释X、Y、Z形成的化合物水溶液呈弱酸性的原因是___。
(5)铋元素跟Y元素能形成化合物(BiY3),其水解生成难溶于水的BiOY。
①BiY3水解反应的化学方程式为___。
②把适量的BiY3溶于含有少量丁的水中,能得到澄清溶液,试分析可能的原因___。
③医药上把BiOY叫做“次某酸铋”,分析这种叫法的不合理之处,为什么。___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com