
【题目】按要求完成下列填空
Ⅰ.已知:① 2C3H8(g) + 7O2(g) ===6CO(g) + 8H2O(l) ΔH=-2741.8 kJ/mol
② 2CO(g) + O2(g) ===2CO2(g) ΔH=-566 kJ/mol
(1)反应C3H8(g) + 5O2(g) ===3CO2(g) + 4H2O(l)的ΔH=______________
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH>0
CO2(g) + H2(g) ΔH>0
① 下列事实能说明该反应达到平衡的是___________(填序号)
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
② 在某温度下,反应物的起始浓度分别为:c(CO)=1 mol/L, c(H2O)=2.4 mol/L; 达到平衡后,CO的转化率为60%,该反应在此温度下的平衡常数是___________
(3)熔融碳酸盐燃料电池的电解质为Li2CO3和 Na2CO3的混合物,燃料为CO,在工作过程中,电解质熔融液的组成、浓度都不变,写出负极发生的电极反应式___________________________。
Ⅱ.某二元酸(H2A)在水中的电离方程式是:H2A=== H++HA-HA-![]() H++A2-
H++A2-
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”)。理由是(用离子方程式表示)____________ ;在Na2A溶液中c(Na+)=_______。
(2)已知0.1 mol/LNaHA溶液的pH=2,则0.1 mol/L H2A溶液中氢离子的物质的量浓度应______0.11 mol/L(填“<”、“>”或“=”),理由_____________________________
(3)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol/L的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液中各离子浓度由大到小的顺序为________________
(4)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是_________。
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中![]() 不变
不变
D.溶液中![]() 减小
减小
【答案】-2219.9 kJ/mol b d 0.5 CO-2e-+ CO32-===2CO2 碱性 A2-+H2O![]() HA-+OH- 2[c(HA-)+c(A2-)] < H2A完全电离出的0.1 mol/L H+对其第二步电离平衡产生抑制 c(Na+)>c(HCO3—)>c(CO32—)>c(OH—)>c(H+) CD
HA-+OH- 2[c(HA-)+c(A2-)] < H2A完全电离出的0.1 mol/L H+对其第二步电离平衡产生抑制 c(Na+)>c(HCO3—)>c(CO32—)>c(OH—)>c(H+) CD
【解析】
(1)由①2C3H8(g)+7O2 (g)=6CO (g)+8H2O(l)△H1=-2741.8kJ/mol,
②2CO (g)+O2(g)=2CO2 (g)△H2=-566kJ/mol,
根据盖斯定律可知,(①+②×3)/2,可得C3H8(g)+5O2 (g)=3CO2 (g)+4H2O(l),其反应热为(△H1+△H2×3)/2=-2219.9kJ/mol,答案为:-2219.9kJ/mol;
(2)①a.由反应可知,反应前后的气体物质的量始终不变,则体系中的压强不发生变化,压强不能判断平衡,a错误;
b.v正(H2)=v逆(CO),反应方向相反,转化为一氧化碳时,正逆反应速率相同,说明反应达到平衡状态, b正确;
c.反应体系中,气体的总质量不变,物质的量也不变,总质量与物质的量的比值不变,即平均相对分子质量始终不变,不能判断是否达到平衡,c错误;
d.CO2的浓度不再发生变化,化学反应达到平衡,则CO2的物质的量不再增加,体积不变,浓度不再变化,d正确;
答案为:bd;
②达到平衡后,CO的转化率为60%,则CO的浓度变化量=1mol/L×60%=0.6mol/L,则;
CO(g)+H2O(g)CO2(g)+H2(g)
开始(mol/L):1 2.4 0 0
变化(mol/L):0.6 0.6 0.6 0.6
平衡(mol/L):0.4 1.8 0.6 0.6
平衡常数k=![]() =0.5,答案为:0.5;
=0.5,答案为:0.5;
(3)由于保持熔融电解质的组成、浓度都不变,而在负极上放电的是CO,故应为CO失电子结合CO32-生成CO2:CO-2e-+CO32-=2CO2,故答案为:CO-2e-+CO32-=2CO2;
Ⅱ.(1)由HA-H++A2-可知,Na2A为强碱弱酸盐,A2-水解显碱性,水解离子反应为A2-+H2OHA-+OH-,在Na2A溶液中,根据物料守恒,A元素在溶液中的形式为:c(HA-)、c(A2-),c(Na+)=2[c(HA-)+c(A2-)],答案为:碱性;A2-+H2OHA-+OH-;2[c(HA-)+c(A2-)];
(2)0.1molL-1H2A溶液,H2A═H++HA-,电离出0.1mol/LH+,由HA-H++A2-,第一步电离出H+,对第二步电离有抑制作用,0.1 mol/LNaHA溶液的pH=2,电离出c(H+)=0.01mol/L,所以溶液中氢离子的物质的量浓度小于0.1mol/L+0.01mol/L,答案为:<;H2A完全电离出的0.1 mol/L H+对其第二步电离平衡产生抑制;
(3)当100mL 3mol/L的NaOH溶液吸收标准状况下4.48L CO2时,2NaOH+ CO2= Na2CO3+ H2O,Na2CO3+ CO2+H2O= NaHCO3,所得溶液为等浓度的碳酸钠和碳酸氢钠的混合液,水解显碱性,且碳酸根的水解程度大于碳酸氢根,碳酸根离子水解后生成碳酸氢根离子,各离子浓度由大到小的顺序为c(Na+)>c(HCO3—)>c(CO32—)>c(OH—)>c(H+);
(4)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释,醋酸的电离平衡正向移动,
A.溶液中醋酸分子数目减小,溶液中导电粒子的数目增加,但浓度减小,故A错误;
B.加水稀释,电离平衡右移,醋酸的电离程度增大,但溶液的体积增大,c(H+)减小,B错误;
C.![]() 同乘以c(H+)得:
同乘以c(H+)得:![]() =Ka/kw,加水稀释,溶液的温度不变,醋酸的电离常数和水的离子积常数不变,
=Ka/kw,加水稀释,溶液的温度不变,醋酸的电离常数和水的离子积常数不变,![]() 不变,C正确;
不变,C正确;
D.醋酸为弱电解质,加水稀释,电离程度增大,醋酸根离子浓度、氢离子浓度减小,溶液中水的电离程度增大,则氢离子浓度减小的程度比醋酸根离子浓度变化小溶液中![]() 减小,D正确;
减小,D正确;
答案为CD。


科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为__________________;得到滤渣1的主要成分为______(写化学式)。
(2)第②步加H2O2的作用是______________________(用离子方程式表示);使用H2O2的优点是____________;调溶液pH的目的是使____________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是 ( )
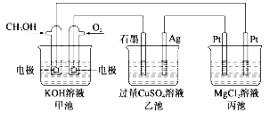
A.甲池电能转化为化学能,乙、丙池化学能转化为电能
B.甲池中通入CH3OH的电极反应式为: CH3OH-6e-+2H2O= CO+8H+
C.甲中消耗280 mL(标准状况下)O2时,丙池理论上最多产生1.45 g固体
D. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列有关金属腐蚀的说法中错误的是
A.纯银饰品久置表面变暗属于化学腐蚀
B.电化学腐蚀和化学腐蚀都是金属被氧化的过程,伴随有电流产生
C.金属发生的电化学腐蚀比化学腐蚀要普遍的多
D.温度越高,金属发生化学腐蚀的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A. 单位时间内生成nmolA2同时生成nmolAB
B. 单位时间内生成2nmolAB的同时生成nmolB2
C. 容器内的总物质的量不随时间变化
D. 单位时间内断开1molA-A键的同时生成2molA-B键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用KClO3分解(MnO2做催化剂)制取氧气,实验后回收剩余固体中的MnO2,正确的操作步骤是
A. 溶解、过滤、蒸发 B. 溶解、过滤、洗涤、干燥
C. 溶解、过滤、结晶 D. 溶解、结晶、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法正确的是( )
A.玻璃是人类最早使用的硅酸盐制品
B.制造水泥的主要原料为纯碱、石灰石和石英
C.硅酸盐制品的性质稳定、熔点较高
D.制造水泥的过程中只发生了物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将nmol/L氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )

A. a点Kw=1.0×10-14
B. 水的电离程度:b>c>a>d
C. b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D. 25℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com