
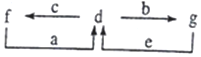 A、B、C、D为原子序数依次增大的短周期元素.已知A的某种单质是自然界中硬度最大的物质,C元素是短周期主族元素中原子半径最大的元素,a为A的最高价氧化物,b、c、d分别为B、C、D的最高价氧化物对应的水化物.化合物a~g的转化关系如图所示(部分产物己略去).下列说法错误的是( )
A、B、C、D为原子序数依次增大的短周期元素.已知A的某种单质是自然界中硬度最大的物质,C元素是短周期主族元素中原子半径最大的元素,a为A的最高价氧化物,b、c、d分别为B、C、D的最高价氧化物对应的水化物.化合物a~g的转化关系如图所示(部分产物己略去).下列说法错误的是( )| A. | 简单离子半径的大小:C>D>B | |
| B. | a中只含共价键,属于共价化合物 | |
| C. | 在水溶液中,b、g均呈酸性,c、f均呈碱性 | |
| D. | 工业上通过电解其氧化物的方法制取D的单质 |
分析 A、B、C、D为原子序数依次增大的短周期元素.由A的某种单质是自然界中硬度最大的物质,A为C;C元素是短周期主族元素中原子半径最大的元素,C为Na;a为A的最高价氧化物,a为CO2,b、c、d分别为B、C、D的最高价氧化物对应的水化物,c为NaOH,结合图中转化可知,d为Al(OH)3,f为NaAlO2,b为HNO3,g为Al(NO3)3,e为氨水等,可知B为N,D为Al,以此来解答.
解答 解:由上述分析可知,A为C,B为N,C为Na,D为Al,
A.具有相同电子排布的离子中原子序数大的离子半径小,则简单离子半径的大小:B>C>D,故A错误;
B.a为CO2,只含共价键,属于共价化合物,故B正确;
C.b为HNO3,g为Al(NO3)3,溶液显酸性,而c为NaOH、f为NaAlO2,溶液显碱性,故C正确;
D.D为Al,工业上通过电解氧化铝的方法制取D的单质,故D正确;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、元素的性质、元素化合物知识来推断元素为解答的关键,侧重分析与应用能力的考查,注意氢氧化铝的两性及规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用植物油的氧化反应可获得人造脂肪 | |
| B. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 工业生产玻璃、水泥和陶瓷,均需用石灰石作原料 | |
| D. | 明矾和“84”消毒液均可用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,0.4mol•L-1一元酸HA与0.2mol•L-1NaOH溶液等体积混合后,所得溶液pH>7,溶液部分微粒组分及浓度如图所示.下列说法正确的( )
常温下,0.4mol•L-1一元酸HA与0.2mol•L-1NaOH溶液等体积混合后,所得溶液pH>7,溶液部分微粒组分及浓度如图所示.下列说法正确的( )| A. | HA是弱酸 | |
| B. | 图中未表示出的微粒的浓度小于0.1mol/L | |
| C. | 该混合溶液中:c(HA)+c(X)═c(Na+) | |
| D. | 图中M表示HA,Y表示OH-,Z表示H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质在一定条件下一定都能水解 | |
| B. | 除去乙醇中的乙酸用分液的方法 | |
| C. | C5H10O2能与NaHCO3反应的结构有4种 | |
| D. | C8H10的同分异构体有三种,它们的性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管用待装液润洗 | B. | 锥形瓶振荡时有少量液体溅出 | ||
| C. | 滴定结束后滴定管末端出现气泡 | D. | 锥形瓶用待测液润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作和现象 | 结论 |
| A | 将Fe(NO3)2样品溶于稀H2SO4,溶液呈黄色. | Fe(NO3)2样品已被氧化变质 |
| B | 室温下,向 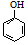 浊液中滴加Na2CO3溶液,浊液变澄清. 浊液中滴加Na2CO3溶液,浊液变澄清. | CO32-结合H+的能力比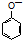 的强 的强 |
| C | 向Na2SiO3溶液中滴加稀硫酸,出现白色胶状沉淀. | 非金属性:S>Si |
| D | 向BaSO4中加入饱和Na2CO3溶液,充分搅拌,静置,过滤,洗涤.向滤渣中加盐酸,有气泡产生. | Ksp(BaCO3)<Ksp(BaSO4) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com