往90mL含16g CuSO4溶质的溶液中加入2.8g Fe粉,反应结束后向溶液中加入一定量水,使溶液的体积变为100mL.试计算:
(1)反应得到的固体的质量是多少?
(2)溶液中含有多少克FeSO4?
(3)此时溶液中Fe2+、Cu2+离子的物质的量浓度各是多少?
【答案】
分析:(1)反应的化学方程式为:Fe+CuSO
4=FeSO
4+Cu,先进行过量计算,根据不足量物质计算,据此解答;
(2)根据不足量的物质计算生成的FeSO
4的质量;
(3)根据不足量的物质的量计算生成的FeSO
4的物质的量、参加反应的CuSO
4的物质的量,进而计算剩余硫酸铜的物质的量,再根据c=
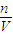
计算.
解答:解:(1)设16g硫酸铜完全反应需要Fe的质量为m,则:
Fe+CuSO
4=FeSO
4+Cu
56 160
m 16g
所以m=5.6g>2.8g,故Fe不足,
设Fe完全反应后,生成Cu的质量ng,则:
Fe+CuSO
4=FeSO
4+Cu
56 64
2.8g ng
故56:64=2.8g:ng,解得n=3.2
答:反应得到的固体的质量是3.2g.
(2)令生成的硫酸亚铁的质量为ag,则:
Fe+CuSO
4=FeSO
4+Cu
56 152
2.8g ag
故56:152=2.8g:ag,解得a=7.6
答:溶液中利用硫酸亚铁的质量是7.6.
(3)2.8gFe的物质的量=
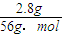
=0.05mol,则Fe
2+离子的物质的量浓度=

=0.5mol/L,
参加反应的硫酸铜为0.05mol,溶液中Cu
2+离子的物质的量=
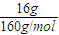
-0.05mol=0.05mol,故Cu
2+离子的物质的量浓度=

=0.5mol/L,
答:溶液中Fe
2+、Cu
2+离子的物质的量浓度各是0.5mol/L、0.5mol/L.
点评:本题考查根据化学方程式的计算,比较基础,旨在考查学生对基础知识的理解掌握,注意过量计算.

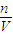 计算.
计算.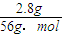 =0.05mol,则Fe2+离子的物质的量浓度=
=0.05mol,则Fe2+离子的物质的量浓度= =0.5mol/L,
=0.5mol/L,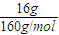 -0.05mol=0.05mol,故Cu2+离子的物质的量浓度=
-0.05mol=0.05mol,故Cu2+离子的物质的量浓度= =0.5mol/L,
=0.5mol/L,

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案