
| A. | 高分子的结构是长链状的 | |
| B. | 高分子间相互作用的分子间力较强 | |
| C. | 高分子化合物链里的原子是以共价键结合的 | |
| D. | 高分子链之间发生了缠绕 |
科目:高中化学 来源: 题型:选择题
| A. | 该粒子不显电性 | B. | 该粒子质量数为4 | ||
| C. | 该粒子的质量数为1 | D. | 该粒子质量比氢原子大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 三种金属的物质的量相等 | |
| B. | 三种金属可能均过量 | |
| C. | 三种金属的质量相等 | |
| D. | 参加反应的三种金属的质量比为12:9:28 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 6种 | C. | 9 种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3-二氯丙烷 | B. | 1,1-二氯丙烷 | C. | 1,2-二氯丙烷 | D. | 2,2-二氯丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑥ | C. | ②④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
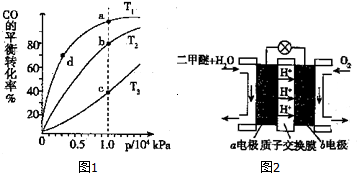
| 容器 | c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | v(正)和v(逆)大小比较 |
| I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v(正)=v(逆) |
| Ⅱ | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | v 正)< v(逆)(填>、<、=) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L硫酸铵溶液中各离子的浓度由大到小的顺序是:c (NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| B. | 在苏打与小苏打的混合溶液中存在:c(Na+)+c(H+)=c(OH -)+2c(CO32-)+c(HCO3-) | |
| C. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,证明Na2CO3溶液中存在水解平衡 | |
| D. | 常温常压下能自发进行的反应,一定都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
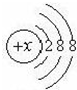 核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:
核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com