
| A.具有玻璃塞的细口瓶 | B.具有玻璃塞的广口瓶 |
| C.带滴管的滴瓶 | D.具有橡胶塞的细口瓶 |
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:

| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ② H2CO3或H2SO4、H2SO3、H2S、HNO3、HNO2 H2CO3或H2SO4、H2SO3、H2S、HNO3、HNO2 |
③ KOH或NaOH KOH或NaOH ④Ba(OH)2 |
⑤Na2CO3 ⑥ K2CO3或K2S、K2SO3、K2SO4、KNO3、KNO2、Na2S、Na2SO3、Na2SO4、NaNO3、NaNO2 K2CO3或K2S、K2SO3、K2SO4、KNO3、KNO2、Na2S、Na2SO3、Na2SO4、NaNO3、NaNO2 |
⑦CO2 ⑧Na2O |
⑨NH3 ⑩H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
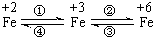 亚铁盐、铁盐、高铁酸盐等铁的重要化合物之间可以相互转化(见图).利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究.
亚铁盐、铁盐、高铁酸盐等铁的重要化合物之间可以相互转化(见图).利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的HNO3与pH=11的KOH溶液 | B、pH=3的醋酸与pH=11的KOH溶液 | C、pH=3的硫酸与pH=11的NaOH溶液 | D、pH=3的盐酸与pH=11的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.pH=3的HNO3与pH=11的KOH溶液
B.pH=3的HNO3与pH=11的氨水
C.pH=3的H2SO4与pH=11的NaOH溶液
D.pH=3的CH3COOH与pH=11的Ba(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
(分)高铁酸钾是一种重要的水的处理剂,实验可用下列流程制取高铁酸钾,

⑴NaClO溶液中加入NaOH固体形成碱性环境。
⑵将研磨的Fe(NO3)3 少量多次的加入到上述溶液中,冰浴中反应1h。
采用少量多次加入,其目的是___________________________;该反应的离子方程为:
_____________________________________。
⑶将KOH加入到反应后的溶液搅拌半小时。静置,抽滤的粗产品。该反应的化学方程式为:_____________________________。
⑷依次用甲苯、乙醇、乙醚洗涤以除去水份和KNO3、KCl、KOH等杂质。
⑸在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色。现称取5.000 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL容量瓶中,定容,量取25.00mL,再用稀硫酸酸化,用0.1000 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,用去标准溶液33.33 mL。
①滴定时适宜选用的滴定管是: (a、酸式,b、碱式)。
②计算上述实验制得的样品中,高铁酸钾的质量分数为_________________。
③若上述过程中,测得的样品中高铁酸盐的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com