
分析 根据A、D、E三种溶液的pH<7,说明A、D、E三种溶液为强酸弱碱盐,水解呈酸性;B溶液呈碱性,A溶液中c(H+)=c(OH-),Ag+不能Cl-、Br-、SO42-、CO32-相结合,因为AgCl、Ag2SO4、Ag2CO3都为白色沉淀,AgBr为浅黄色沉淀,只能形成AgNO3;
B溶液中c(H+)=1×10-12mol•L-1,呈碱性,只能是强碱弱酸盐溶液,而Na+、Ba2+为强碱阳离子,CO32-为弱酸根离子,因此B只能为Na2CO3;A+B→白色沉淀+无色气体,该反应应该为双水解反应,能够发生双水解反应的离子为:2Al3++3CO32-+3H2O═2Al(OH)3↓+CO2↑,则A中含有Al3+;E+D→淡黄色沉淀,该沉淀为AgBr,则E、D中含有Br-,故A只能为Al2(SO4)3或AlCl3;C溶液中由H2O电离出的c(H+)=1×10-7mol•L-1,则C为中性溶液,则C为强酸强碱盐,C中一定含有Ba2+,只能为BaCl2;则A为Al2(SO4)3;D、E为含有Br-的强酸弱碱盐,则D、E为NH4Br、AgNO3;根据C+E→白色沉淀可知,E为AgNO3、D为NH4Br,据此进行解答.
解答 解:(1)A、D、E三种溶液的pH<7,说明A、D、E三种溶液为强酸弱碱盐,水解呈酸性;B溶液呈碱性,A溶液中c(H+)=c(OH-),Ag+不能Cl-、Br-、SO42-、CO32-相结合,因为AgCl、Ag2SO4、Ag2CO3都为白色沉淀,AgBr为浅黄色沉淀,只能形成AgNO3;
B溶液中c(H+)=1×10-12mol•L-1,呈碱性,只能是强碱弱酸盐溶液,而Na+、Ba2+为强碱阳离子,CO32-为弱酸根离子,因此B只能为Na2CO3;A+B→白色沉淀+无色气体,该反应应该为双水解反应,能够发生双水解反应的离子为:2Al3++3CO32-+3H2O═2Al(OH)3↓+CO2↑,则A中含有Al3+;E+D→淡黄色沉淀,该沉淀为AgBr,则E、D中含有Br-,故A只能为Al2(SO4)3或AlCl3;C溶液中由H2O电离出的c(H+)=1×10-7mol•L-1,则C为中性溶液,则C为强酸强碱盐,C中一定含有Ba2+,只能为BaCl2;则A为Al2(SO4)3;D、E为含有Br-的强酸弱碱盐,则D、E为NH4Br、AgNO3;根据C+E→白色沉淀可知,E为AgNO3、D为NH4Br;
根据分析可知,A为Al2(SO4)3,B为Na2CO3,C为BaCl2,D为NH4Br,E为AgNO3,
故答案为:Al2(SO4)3;NH4Br;AgNO3;
(2)D为NH4Br,铵根离子部分水解,溶液显示酸性,水解的离子方程式为:NH4++H2O?NH3•H2O+H+,
故答案为:NH4++H2O?NH3•H2O+H+;
②A为Al2(SO4)3,B为Na2CO3,二者在溶液中反应生成氢氧化铝沉淀、二氧化碳气体、硫酸钠,反应的离子方程式为:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑,
故答案为:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑;
③C为BaCl2,E为AgNO3,二者反应生成硝酸钠和氯化银沉淀,反应的离子方程式为:Ag++Cl-═AgCl↓,
故答案为:Ag++Cl-═AgCl↓.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质及检验方法为解答关键,注意掌握盐的水解原理、离子共存等知识的综合应用,试题培养了学生的灵活应用能力.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 漂白粉保存在密闭容器中 | B. | 新制氯水保存在棕色瓶中 | ||
| C. | AgBr保存在普通玻璃试剂瓶中 | D. | 往液溴中加少量水并密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体无色、透明,能产生丁达尔效应 | |
| B. | 硫酸溶液的导电性一定比醋酸溶液的导电性强 | |
| C. | 用萃取分液的方法除去酒精中的水 | |
| D. | SO3溶于水后得到的溶液可以导电,但SO3是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4.0的番茄汁中c(H+)是pH=6.0的牛奶中c(H+)的100倍 | |
| B. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| C. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
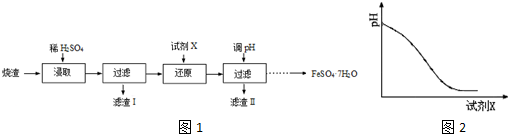
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操 作 | 现 象 |
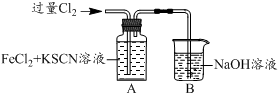 | I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (或
(或
 ).
).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com