
科目:高中化学 来源: 题型:
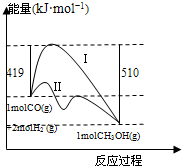 (2010?石家庄模拟)已知反应CO(g)+2H2(g)?CH3OH(g)的能量情况如图所示,曲线I和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
(2010?石家庄模拟)已知反应CO(g)+2H2(g)?CH3OH(g)的能量情况如图所示,曲线I和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 (2010?西城区模拟)熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池,其工作原理如图所示:
(2010?西城区模拟)熔融碳酸盐燃料电池是以熔融的碳酸盐为电解质的燃料电池,其工作原理如图所示:| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
已知反应CO(g) C(s)+1/2O2(g)的△H为正值,△S为负值。若△H和△S随温度的变化忽略不计,下列说法中正确的是 ( )
C(s)+1/2O2(g)的△H为正值,△S为负值。若△H和△S随温度的变化忽略不计,下列说法中正确的是 ( )
A.低温下反应是自发进行,高温下反应是非自发进行
B.任何温度下反应都是自发进行
C.低温下反应是非自发进行,高温下反应是自发进行
D.任何温度下反应都是非自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com