
【题目】将O2、CH4、Na2O2置于密闭容器中,在250℃下用电火花引发化学反应。反应停止后使容器内恢复至250℃,容器内的气压为零。由此得出的结论正确的是( )
A. 原O2、CH4、Na2O2物质的量之比为1∶2∶6,反应后容器内生成的固体是Na2CO3和NaOH
B. 原O2、CH4、Na2O2物质的量之比为2∶1∶4,反应后容器内生成的固体是Na2CO3和NaOH
C. 原O2、CH4、Na2O2物质的量之比为1∶2∶6,反应后容器内生成的固体是Na2CO3和NaHCO3
D. 原O2、CH4、Na2O2物质的量之比为2∶1∶4,反应后容器内生成的固体是NaHCO3和NaOH
【答案】A
【解析】
根据题意知反应后容器内的气压为零且无Na2O2存在,说明三种反应物转化为Na2CO3和NaOH,根据质量守恒可写出反应的总反应为O2+2CH4+6 Na2O2![]() 2 Na2CO3+8NaOH,以此进行分析。
2 Na2CO3+8NaOH,以此进行分析。
题中涉及的化学反应为:CH4+2O2![]() CO2+2H2O,2CO2+2Na2O2=2Na2CO3+O2,2H2O+2 Na2O2=4NaOH +O2,反应停止后的容器内温度仍为250℃,气压为零,说明容器内无气体存在,也不可能有NaHCO3,O2、CH4、Na2O2三者之间的综合反应关系为:O2+2CH4+6 Na2O2
CO2+2H2O,2CO2+2Na2O2=2Na2CO3+O2,2H2O+2 Na2O2=4NaOH +O2,反应停止后的容器内温度仍为250℃,气压为零,说明容器内无气体存在,也不可能有NaHCO3,O2、CH4、Na2O2三者之间的综合反应关系为:O2+2CH4+6 Na2O2![]() 2Na2CO3+8NaOH,反应方程式中O2、CH4、Na2O2计量数之比为1:2:6,
2Na2CO3+8NaOH,反应方程式中O2、CH4、Na2O2计量数之比为1:2:6,
所以A选项是正确的。


 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】已知(Ⅰ)、(Ⅱ)反应在一定条件下焓变及平衡常数如下:
2H2(g)+S2(g)2H2S(g) ΔH1 K1 (Ⅰ)
3H2(g)+SO2(g)2H2O(g)+H2S(g) ΔH2 K2 (Ⅱ)
(1)用ΔH1、ΔH2表示反应4H2(g)+2SO2(g)=S2(g)+4H2O(g)的ΔH=________。
(2)回答下列反应(Ⅰ)的相关问题:
①温度为T1,在1 L恒容容器中加入1.8 mol H2、1.2 mol S2,10 min时反应达到平衡。测得10 min内v(H2S)=0.08 mol·L-1·min-1,则该条件下的平衡常数为________。
②温度为T2时(T2>T1),在1 L恒容容器中也加入1.8 mol H2、1.2 mol S2,建立平衡时测得S2的转化率为25%,据此判断ΔH1________0(填“>”或“<”),与T1时相比,平衡常数K1__(填“增大”“减小”或“不变”)。
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是________________(写出主要反应的离子方程式),该溶液中,c(Na+)______2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的水解平衡常数=________。
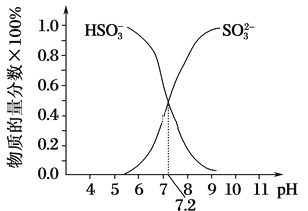
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3 和NaHCO3的说法错误的是
A. 等质量Na2CO3 和NaHCO3分别和足量盐酸反应,相同条件下前者生成CO2少
B. 将石灰水分别加入NaHCO3和Na2CO3中,前者不生成沉淀
C. 相同条件下Na2CO3 比NaHCO3更易溶于水
D. Na2CO3 固体中含少量NaHCO3,可用加热法除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值下列有关说法中正确的是( )
A.常温常压下,46gN2O4中含氧原子数为2NA
B.常温常压下,11.2LNH3中含共价键的数目为1.5NA
C.电解精炼铜阳极质量减少32g时电路中转移电子总数为NA
D.1L0.2mol/LNa2SO4溶液中含有阴阳离子总数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有黄绿色气体乙为Cl2,金属单质A、B和气体甲、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中某些反应的产物及条件没有全部标出)
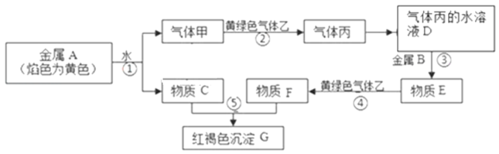
(1)丙的化学式为___;
(2)F溶液常用于腐蚀印刷电路板,请写出相关的离子方程式:___;
(3)为鉴定B单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是___;
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
(4)C溶液中加入过量的Al2O3固体的离子反应方程式为___;向反应后的溶液中通入过量的CO2气体的离子反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一无色透明的溶液做如下实验:
①取少量溶液滴加盐酸酸化的BaCl2溶液有白色沉淀生成。
②另取部分溶液加入Na2O2,有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成沉淀的量的关系如图所示,试问:
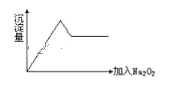
(1)Cu2+、NH4+、Al3+、Mg2+、Na+、Fe3+、K+、SO42-等离子中一定存在的离子是__;可能存在的离子是__;一定不存在的离子是___。
(2)上述溶液至少由___等物质混合成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计的微型实验装置验证SO2的性质,通过分析实验,下列结论表达正确的是( )

A.a棉球褪色,验证SO2具有氧化性
B.c棉球蓝色褪去,验证SO2漂白性
C.b棉球褪色,验证SO2具有酸性氧化物的通性
D.可以使用浓硫酸吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com