
分析 A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,外围电子排布为3s2p4,故A为S元素;B原子核外的L层电子数是K层的两倍,L层电子数为4,故B为碳元素;C是地壳内含量(质量分数)最高的元素,则C为O元素;D的核电荷数是A与C的核电荷数之和,D的核电荷数为16+8=24,则D为Cr;E在元素周期表的各元素中电负性最大,则E为F元素,据此解答.
解答 解:A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,外围电子排布为3s2p4,故A为S元素;B原子核外的L层电子数是K层的两倍,L层电子数为4,故B为碳元素;C是地壳内含量(质量分数)最高的元素,则C为O元素;D的核电荷数是A与C的核电荷数之和,D的核电荷数为16+8=24,则D为Cr;E在元素周期表的各元素中电负性最大,则E为F元素.
(1)由上述分析可知,A、B的元素符号依次为S、C,故答案为:S;C;
(2)SO2分子中S原子孤电子对数=$\frac{6-2×2}{2}$=1,价层电子对数为2+1=3,故其立体结构为V形;CO2分子为直线形结构,SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子,故SO2在水中溶解度较大,
故答案为:V形;直线形;SO2;SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子;
(3)D为Cr,核外电子数为24,核外电子排布式为1s22s22p63s23p63d54s1,在形成化合物时它的最高化合价为+6,
故答案为:1s22s22p63s23p63d54s1;+6.
点评 本题是对物质结构与性质的考查,推断元素是解题关键,涉及核外电子排布、分子结构与性质等,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③ | |
| C. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)═c(OH-)+c(HC2O4-) | |
| D. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气.根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置:
氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气.根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸氢铵和氢氧化钠等物质的量混合 NH4++OH-═NH3↑+H2O | |
| B. | 向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O | |
| C. | 将Fe2O3溶于氢碘酸中Fe2O3+6H+═2Fe3++3H2O | |
| D. | 等物质的量的溴化亚铁跟氯气反应2Fe2++2Br-+2Cl2═2F3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 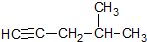 :4-甲基-1-戊炔 :4-甲基-1-戊炔 | B. | CH3CH(CH3)CH=CHCH3:2-甲基-3-戊烯 | ||
| C. | 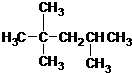 :2,2,4-三甲基戊烷 :2,2,4-三甲基戊烷 | D. |  :间二硝基苯 :间二硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸溶液中:K+、Fe2+、MnO4-、SO42- | |
| B. | $\frac{{K}_{w}}{c(O{H}^{-})}$=0.1mol/L的溶液:Na+、K+、SiO32-、NO3- | |
| C. | 既能溶解Al(OH)3又能溶解 H2SiO3的溶液中:Na +、CO32-、SO32-、NO3- | |
| D. | 在含有大量HCO3-的溶液中:K+、Na+、AlO2-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

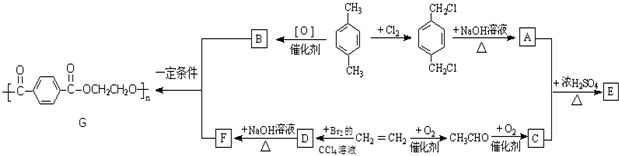
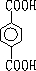
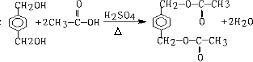
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -8Q kJ•mol-1 | B. | +16Q kJ•mol-1 | C. | +8Q kJ•mol-1 | D. | -16Q kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com