
| A | C | |
| B |
分析 A、B、C为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B处于第三周期,令A原子核外电子为x,则B质子数为x+9,C核外电子数为x+2,则:x+x+2=x+9,解得x=7,故A为N元素、B为S元素、C为F元素,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:(1)由以上分析可知B为氧元素,C为氟元素,故答案为:硫;氟;
(2)B为S元素,位于周期表第三周期ⅥA族,故答案为:3;ⅥA;
(3)用石墨为电极,电解硫元素的最高价氧化物的水化物的水溶液,阳极生成氧气,阴极生成氢气,总方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,当电路中转移0.4mol电子时,以及生成0.2mol氢气,质量为0.4g,
故答案为:H2;0.4;2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑;
(4)N的气态氢化物为氨气,与其最高价氧化物对应的水化物硝酸反应生成硝酸铵,反应的化学方程式为NH3+HNO3═NH4NO3,
故答案为:NH3+HNO3═NH4NO3.
点评 本题考查了元素周期表和元素周期律综合应用,为高考常见题型,侧重考查学生的分析能力,注意把握元素周期表结构和原子结构,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | HCl溶于水、NaCl溶于水破坏的化学键类型相同 | |
| B. | 碘升华、NaCl 颗粒被粉碎,均破坏化学键 | |
| C. | 氦气、液溴、硫磺中均存在共价键 | |
| D. | 钠与水反应、钠与氧气反应,均存在离子键的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
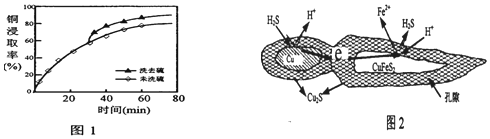
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶内有少量蒸馏水 | |
| B. | 溶液从烧杯中转移到容量瓶时,没有洗涤烧杯 | |
| C. | 定容时观察液面时俯视定容 | |
| D. | 配溶液的Na2CO3•10H2O晶体在空气中久置风化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
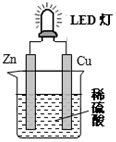
| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将硫酸换成橙汁,导线中不会有电子流动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
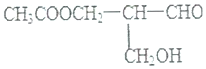
| A. | 与NaOH溶液共热 | B. | 与甲酸发生酯化反应 | ||
| C. | 与碱性Cu(OH)2悬浊液反应 | D. | 在催化剂存在下与H2作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
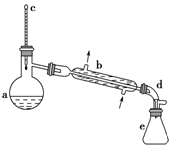 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图: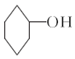 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$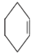 +H2O,
+H2O,| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
 ,生成该物质的反应类型是取代反应
,生成该物质的反应类型是取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 12g石墨中含有σ键的个数为2NA (NA表示阿伏伽德罗常数) | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com