
| A. | ①③ | B. | ③④ | C. | ②③ | D. | ②④ |
分析 ①钢铁腐蚀时正极得到电子发生还原反应,在弱酸性或中性条件下氧气得到电子生成氢氧根离子;
②向KHSO4溶液中滴入Ba(OH)2溶液至pH=7,则氢离子与氢氧根离子恰好反应,硫酸氢钾和氢氧化钡按照物质的量2:1反应;
③明矾电离出的铝离子发生水解生成氢氧化铝和氢离子;
④苯酚的酸性大于碳酸氢根离子,二者反应生成苯酚和碳酸氢钠.
解答 解:①在弱酸性或中性条件下,钢铁腐蚀时正极氧气得到电子,正极反应为:2H2O+O2=4e-=4OH-,故①正确;
②向KHSO4溶液中滴入Ba(OH)2溶液至pH=7,溶液呈中性,氢离子与氢氧根离子恰好反应,正确的离子方程式为:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O,故②错误;
③明矾在溶液中电离出铝离子,铝离子发生水解的离子方程式为:Al3++3H2O?Al(OH)3+3H+,故③正确;
④苯酚钠溶液中通入少量二氧化碳,由于苯酚的酸性大于碳酸氢根离子,二者反应生成苯酚和碳酸氢根离子,正确的离子方程式为:C6H6O-+CO2+H2O→C6H5OH+HCO3-,故④错误;
故选D.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,④为易错点,注意苯酚的酸性大于碳酸氢根离子,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | CO32- | B. | HCO3- | C. | NO3- | D. | SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
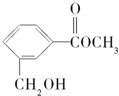
| A. | 有机物M中有2种含氧官能团 | |
| B. | 1mol有机物M可与1mol NaOH发生反应 | |
| C. | 有机物M能与溴水发生加成反应 | |
| D. | 1mol有机物M最多能与3mol H2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOCH2CH2CH3 | B. | CH3CH2COOCH2CH3 | ||
| C. | CH3COOCH2CH3 | D. | CH3CH2COOCH2CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
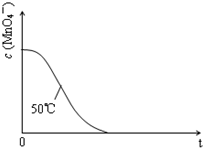 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案.
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如表的方案. | 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com