

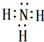 ,故答案为:
,故答案为: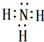 ;
;| 16g |
| 32g/mol |
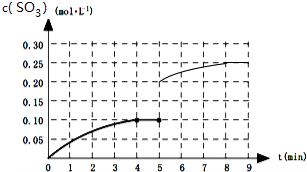 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E | F |
| 化合价 | -2 | -1 | -2、+6 | +4、-4 | +3 | +1 |
| 原子半径(nm) | 0.074 | 0.099 | 0.102 | 0.117 | 0.143 | 0.186 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 催化剂 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、野外焚烧垃圾 |
| B、使用一次性木质筷子 |
| C、大量使用化肥、农药 |
| D、推广使用散装水泥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡是生成盐和水的反应都是中和反应 |
| B、复分解反应一定没有单质参加 |
| C、生成一种单质和一种化合物的反应一定是置换反应 |
| D、分解反应一定不是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何物质都含有6.02×1023个原子 |
| B、0.012kg12C含有6.02×1023个碳原子 |
| C、阿伏加德罗常数的“集体“就是1mol |
| D、使用摩尔这一单位时必须指明微粒的符号 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com