
 (1)如图Ⅰ所示,装置的B极上有大量气泡逸出,则B极是正(填“正”或“负”,下同)极
(1)如图Ⅰ所示,装置的B极上有大量气泡逸出,则B极是正(填“正”或“负”,下同)极科目:高中化学 来源: 题型:选择题
| A. | 对于吸热反应,反应物所具有的总能量低于生成物所具有的总能量 | |
| B. | 任何放热反应在常温条件一定能发生反应 | |
| C. | 原电池反应一定是氧化还原反应 | |
| D. | 元素由化合态变成游离态时,它可能被氧化,也可能被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 a、b、c、d、e、f是原子序数依次增大的6种短周期元素,a、d同主族,a是原子半径最小的元素,b的最高正化合价与最低负化合价的代数和为零,a与c、d与c均可形成原子个数之比为2:1和1:1的化合物,d、e的最外层电子数之和等于b的最外层电子数,f是同周期中得电子能力最强的元素.
a、b、c、d、e、f是原子序数依次增大的6种短周期元素,a、d同主族,a是原子半径最小的元素,b的最高正化合价与最低负化合价的代数和为零,a与c、d与c均可形成原子个数之比为2:1和1:1的化合物,d、e的最外层电子数之和等于b的最外层电子数,f是同周期中得电子能力最强的元素. .a、c、d三种元素形成的化合物中存在的化学键类型是离子键、共价键.
.a、c、d三种元素形成的化合物中存在的化学键类型是离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:6 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定含有氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
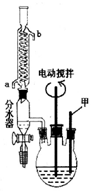 苯甲酸(C6H5COOH式量:122,熔点122.4℃,密度为1.2659g•cm-3)是一种一元有机弱酸,微溶于水易溶于乙醇.实验室中由甲苯(式量:92,密度为0.8669g•cm-3)制备苯甲酸的实验如下:
苯甲酸(C6H5COOH式量:122,熔点122.4℃,密度为1.2659g•cm-3)是一种一元有机弱酸,微溶于水易溶于乙醇.实验室中由甲苯(式量:92,密度为0.8669g•cm-3)制备苯甲酸的实验如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com