
(13分)水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液中,溶液的pH= 。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为 ,由水电离出的c(OH-)= mol·L-1。
(3)体积均为100 mL、pH均为2的盐酸与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,

则HX是 (填“强酸”或“弱酸”),理由是 。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为 (填化学式)。
②25 ℃时,在0.5 mol/L 的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的 倍。
(1)11(2分)(2)CO32-+H2O HCO3-+OH- (2分) 10-3 (2分)
HCO3-+OH- (2分) 10-3 (2分)
(3)弱酸(1分);稀释相同倍数,一元酸HX的pH变化量比HCl的小,说明HX存在电离平衡,故HX为弱酸。(2分) (4)①Na2CO3>NaCN>CH3COONa(2分) ②9×108(2分)
【解析】
试题分析:(1)纯水在100 ℃时,pH=6,这说明该温度下水的离子积常数是10-12,因此该温度下0.1 mol·L-1的NaOH溶液中,氢离子浓度是10-11mol/L,则溶液的pH=11。
(2)25 ℃时,向水中加入少量碳酸钠固体,碳酸根水解,得到pH为11的溶液,则其水解的离子方程式为CO32-+H2O HCO3-+OH- ,其中由水电离出的c(OH-)等于溶液中氢氧根离子的浓度,即由水电离出的c(OH-)=10-3mol·L-1。
HCO3-+OH- ,其中由水电离出的c(OH-)等于溶液中氢氧根离子的浓度,即由水电离出的c(OH-)=10-3mol·L-1。
(3)根据图像可知,稀释相同倍数时,一元酸HX的pH变化量比HCl的小,这说明HX存在电离平衡,因此HX为弱酸。
(4)①电离常数越大酸性越强,酸性越强相应的钠盐越容易水解,溶液的碱性越强。根据表中数据可知酸性强弱顺序为CH3COOH>H2CO3>HCN>HCO3-,所以25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为Na2CO3>NaCN>CH3COONa。
②根据电离常数可知25 ℃时,在0.5 mol/L 的醋酸溶液中氢离子浓度是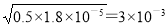 mol/L,则溶液中氢氧根离子的浓度是
mol/L,则溶液中氢氧根离子的浓度是 ×10-11mol/L,因此醋酸溶液中由水电离出的氢离子浓度也是
×10-11mol/L,因此醋酸溶液中由水电离出的氢离子浓度也是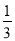 ×10-11mol/L,所以由醋酸电离出的c(H+)约是由水电离出的c(H+)的
×10-11mol/L,所以由醋酸电离出的c(H+)约是由水电离出的c(H+)的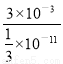 9×108倍。
9×108倍。
考点:考查弱电解质的电离、盐类水解等有关应用与计算


科目:高中化学 来源:2014-2015学年浙江省宁波市高三一月化学试卷(解析版) 题型:选择题
对于反应CO2(g)+H2(g)  CO(g)+H2O(g) ΔH>0,在其他条件不变的情况下
CO(g)+H2O(g) ΔH>0,在其他条件不变的情况下
A.加入催化剂,改变了反应的速率,反应的ΔH也随之改变
B.降低温度,反应速率减慢,反应放出的热量不变
C.改变反应体系体积,平衡不发生移动,反应放出的热量不变
D.若将上述反应改为在燃料电池进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
下表中叙述Ⅰ和叙述Ⅱ均正确并且互为因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | NH4Cl是强酸弱碱盐 | 将NH4Cl溶液蒸干可制备NH4Cl固体 |
B | Fe3+有强氧化性 | 用KSCN溶液可以鉴别Fe3+ |
C | SO2有还原性 | 用SO2可使溴水褪色 |
D | Cl2有漂白性 | 用Cl2可与石灰乳反应制备含氯消毒剂 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市高三1月调研理综化学试卷(解析版) 题型:选择题
茶叶中铁元素的检验可经过以下四个步骤完成:将茶叶灼烧灰化→用浓硝酸溶解茶叶灰→过滤得到的滤液→检验滤液中的Fe3+。下图是可能用到的实验用品。

有关该实验的说法中正确的是
A.第一步需选用仪器①、②和⑨,①的名称叫钳埚
B.第二步用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦
C.要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸
D.第四步,若滤液中含有Fe3+,加入⑧中的溶液后滤液会显红色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省武汉市武昌区高三元月调考理综化学试卷(解析版) 题型:填空题
【化学—选修5:有机化学基础】(15分)以下是合成香料香豆素的路径图:
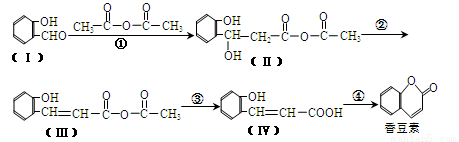
(1)香豆素的分子式为 。
(2)Ⅰ与H2反应生成邻羟基苯甲醇,邻羟基苯甲醇的结构简式为 。
(3)反应②的反应类型是 。
(4)反应④的化学方程式是 。
(5)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,且能够发生酯化反应和银镜反应。Ⅴ的结构简式为 。
(6)一定条件下, 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 。
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省武汉市武昌区高三元月调考理综化学试卷(解析版) 题型:选择题
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析正确的是
A.上述实验条件下,物质的氧化性:Cu2+ > I2 > SO2
B.通入SO2时,SO2与I2反应,I2作还原剂
C.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
D.滴加KI溶液时,转移2 mol e- 时生成1 mol白色沉淀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
一定温度下,10mL0.40mol/L H2O2溶液发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L?min)
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L?min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉)。下列说法错误的是
A.阴极附近溶液呈红色 B.阴极逸出气体
C.阳极附近溶液呈蓝色 D.溶液的pH变小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.NaCl溶于水在电流作用下电离成钠离子和氯离子
B.电离时生成的阳离子有H+ 的化合物叫做酸
C.CO2的水溶液能导电,所以CO2 是电解质
D.固体NaCl不导电,但NaCl是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com