
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
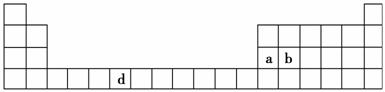
(1)请写出元素d的基态原子电子排布式________________________________________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是________。其中b原子的杂化方式是________。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
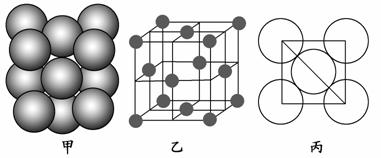
若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为Mr,则一个晶胞中a原子的数目为________,该晶体的密度为________(用字母表示)。
科目:高中化学 来源: 题型:
下列分子或离子在指定的分散系中能大量共存的一组是( )
A.银氨溶液:Na+、K+、NO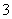 、NH3·H2O
、NH3·H2O
B.空气:C2H2、CO2、SO2、NO
C.氢氧化铁胶体:H+、K+、S2-、Br-
D.高锰酸钾溶液:H+、Na+、SO 、葡萄糖分子
、葡萄糖分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.过氧化钠和水反应:2Na2O2+2H2O===4Na++4OH-+O2↑
B.用铜为电极电解饱和食盐水:2Cl-+2H2O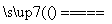 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.在明矾溶液中滴加过量氨水:Al3++4NH3·H2O===AlO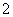 +4NH
+4NH +2H2O
+2H2O
D.向小苏打溶液中加少量Ba(OH)2溶液:HCO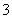 +Ba2++OH-===BaCO3↓+H2O
+Ba2++OH-===BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好。下图是以煤为原料生产聚氯乙烯(PVC)和人造羊毛的合成路线。
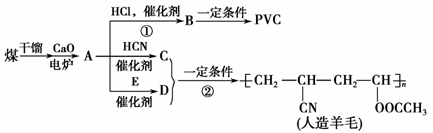
请回答下列问题:
(1)写出反应类型:反应①________,反应②________。
(2)写出结构简式:PVC________,C________。
(3)写出A—→D的化学反应方程式:______________。
(4)与D互为同分异构体且可发生碱性水解的物质有____________种(不包括环状化合物),写出其中一种的结构简式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
第4周期中,未成对电子数最多的元素是________。(填名称)
(1)它位于第________族。
(2)核外电子排布式是________。
(3)它有________个电子层,________个原子轨道,________种运动状态不同的电子。
(4)外围电子排布式________,外围电子轨道表示式__________。
(5)属于________区。
查看答案和解析>>
科目:高中化学 来源: 题型:
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,x越大,其原子吸引电子的能力越强。下面是某些短周期元素的x值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
(1)通过分析x值变化规律,确定Mg的x值范围:____<x(Mg)<________。
(2)推测x值与原子半径的关系是________________________________________;
根据短周期元素的x值变化特点,体现了元素性质的________________变化规律。
(3)分别指出下列两种化合物中氧元素的化合价:HClO________,HFO________。
(4)经验规律告诉我们:成键的两原子相应元素x数值的差值为Δx,当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是________________。
(5)预测元素周期表中,x值最小的元素位于第________周期第________族(放射性元素除外)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com