
A、用坩埚灼烧MgCl2?6H2O的反应式:MgCl2?6H2O
| ||||
| B、在0.1mol?L-1 Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) | ||||
| C、常温下,将PH=2的稀硫酸稀释10倍,其中各离子的浓度都变为原来的十分之一 | ||||
| D、蛋白质肽链中-NH-上的氢原子与羰基上的氧原子形成氢键是蛋白质二级结构的主要依据 |
| ||


科目:高中化学 来源: 题型:

| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 0.1gMnO2粉末 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 0.1gMnO2粉末 |

| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食醋用氢氧化钠溶液滴定,开始时溶液的pH通常变化缓慢,当接近滴定终点时,pH 出现突变,称为滴定突跃 |
| B、结晶时,若沉淀的结晶颗粒较大,静置后容易沉降到容器底部,此时,进行分离的操作方法是倾析 |
| C、抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作的主要原理是抽气泵给吸滤瓶减压,导致装置内部的压强降低,使过滤的速度加快 |
| D、在纸层析法分离Fe3+和Cu2+的实验中,层析后,经氨熏,滤纸中无色带出现,一定是误将试样点浸没在展开剂中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体 |
| B、过氧乙酸与苯酚混合使用,可增强过氧乙酸杀菌效果 |
C、由下列过氧乙酸的制取原理可以看出,过氧乙酸是酯的同系物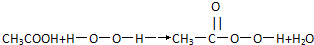 |
| D、浓过氧乙酸溶液中加入少许紫色石蕊试液,振荡后先变红,后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn、Ag |
| B、Cu、Fe |
| C、Al、Fe |
| D、Mg、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
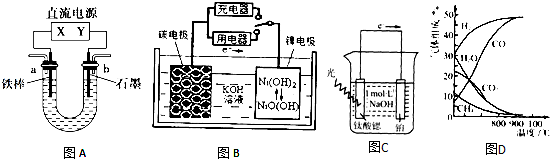
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2ClO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×105 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=1.8×10-11 |
| A、相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
| B、碳酸钠溶液中滴加少量氯水的离子方程式为CO2-3+Cl2+H2O=HCO-3+Cl-+HClO |
| C、向0.1mol?L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5 |
| D、向浓度均为1×10-3mol?L-1的KCl和K2CrO4混合液中滴加1×10-3mol?L-1的AgNO3溶液,CrO2-4先形成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、催化剂能降低正反应的活化能,但不能改变逆反应的活化能 |
| B、在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| C、由C(石墨)→C(金刚石);△H=+73 kJ/mol,可知金刚石比石墨稳定 |
| D、在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com