
| A. | Sr为于第4周期ⅡA 族 | |
| B. | ${\;}_{38}^{90}$Sr核内中子数与质子数之差为14 | |
| C. | ${\;}_{38}^{90}$Sr与${\;}_{39}^{90}$Y互为同位素 | |
| D. | ${\;}_{38}^{90}$Sr的核内质子数为38,Sr元素的相对原子质量为90 |
分析 A.锶的原子序数为38,原子核外五个电子层,最外层2个电子;
B.原子质量数=质子数+中子数;
C.质子数相中子数不同的同种元素的不同原子互为同位素;
D.原子符号左下角为质子数,左上角为质量数,元素的相对原子质量是各种同位素的平均值;
解答 解:A.锶的原子序数为38,原子核外五个电子层,最外层2个电子,位于周期表的缔五周期第ⅡA 族,故A错误;
B.Sr核内中子数为90-38=52,质子数为38,中子数和质子数之差=52-38=14,故B正确;
C.${\;}_{38}^{90}$Sr与${\;}_{39}^{90}$Y质子数不同,不互为同位素,故C错误;
D.${\;}_{38}^{90}$Sr的核内质子数为38,Sr元素的相对原子质量等于其同位素的相对原子质量的平均值,故D错误;
故选B.
点评 本题考查元素周期表的结构及其应用,明确质子数、中子数和质量数的关系是解题的关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
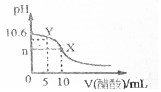 已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )
已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )| A. | n=7 | |
| B. | 水的电离程度先增大再减小 | |
| C. | 常温下醋酸的电离常数约是1.67×10-5 | |
| D. | Y点溶液中c(NH3•H2O)+c(OH-)=c(CH3COO-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向硝酸溶液中加入碳酸钠,有大量气泡产生 | 酸性:碳酸>硝酸 |
| B | 向1mL 某溶液中,滴入2mL 0.1mol•L-1 NaOH溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体 | 某溶液中含NH4+ |
| C | 取5mL 0.1mol•L-1FeCl3溶液,滴加5滴0.1mol•L-1KI溶液,振荡,再加入5mL CCl4,振荡,静置,取上层液体,向取出来的溶液中滴加KSCN溶液,显血红色. | KI和FeCl3反应有一定的限度 |
| D | 加热使冰化成液态水 | 分子内H-O键发生断裂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO-+H2O?CH3COOH+OH- | B. | HCO3-+H2O?CO32-+H3O+ | ||
| C. | CH3COOH+OH-?CH3COO-+H2O | D. | NaCl+H2O?NaOH+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 面粉生产车间应严禁烟火 | |
| B. | NH3泄露时向空中喷洒水雾 | |
| C. | 含Cl2的尾气用碱溶液处理后再排放 | |
| D. | 金属钠失火时应立即用大量冷水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列关系不正确的是( )
,下列关系不正确的是( )| A. | 原子半径:K>Ga>Al | B. | 碱性:KOH>Ga(OH)3>Al(OH) 3 | ||
| C. | 离子的氧化性:K+>Ga3+>Al3+ | D. | 与水反应的剧烈程度:K>Ga>Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com