
【题目】膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。

(1)A装置是__________,B装置是_____________(填“原电池”或“电解池”)。
(2)N2O5在电解池的_____(填“c极”或“d极”)区生成,其电极反应式为______________。
(3)A装置中通入O2的一极是____极,其电极反应式为_________________;通入SO2的一极是_____极,其电极反应式为_________________。
【答案】原电池 电解池 c极 N2O4+2HNO3-2e-![]() 2N2O5+2H+ 正 O2+4H++4e-
2N2O5+2H+ 正 O2+4H++4e-![]() 2H2O 负 SO2-2e-+2H2O
2H2O 负 SO2-2e-+2H2O![]() SO42-+4H+
SO42-+4H+
【解析】
由于B装置中c、d两极均为惰性电极,不符合构成原电池的条件,因此可推知A装置为原电池(可视作燃料电池),用来制备H2SO4,B装置为电解池,用来制备N2O5,A装置为B装置提供电能。A中通入SO2的一极发生氧化反应,为原电池负极,通入O2的一极发生还原反应,为原电池正极,c电极与电池正极相连,c是阳极;d与与电池负极相连,d是阴极。
(1)由于B装置中c、d两极均为惰性电极,不符合构成原电池的条件,因此可推知A装置为原电池,用来制备H2SO4,B装置为电解池。
(2)N2O4发生氧化反应生成N2O5,所以N2O5在电解池的c极(阳极)生成,电极反应式是N2O4+2HNO3-2e-![]() 2N2O5+2H+;
2N2O5+2H+;
(3)A装置中O2得电子发生还原反应,通入O2的一极是正极,其电极反应式为O2+4H++4e-![]() 2H2O;SO2发生氧化反应生成硫酸,通入SO2的一极是负极,其电极反应式为SO2-2e-+2H2O
2H2O;SO2发生氧化反应生成硫酸,通入SO2的一极是负极,其电极反应式为SO2-2e-+2H2O![]() SO42-+4H+。
SO42-+4H+。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某配位化合物为深蓝色晶体,由原子序数由小到大的A,B,C,D,E五种元素组成,其原子个数比为14∶4∶5∶1∶1。其中C,D同主族且原子序数D为C的2倍,E元素的外围电子排布式为(n-1)dn+6ns1,试回答下列问题:
(1)该配位化合物的化学式为________________________,配合物中采取sp3杂化的原子按第一电离能由大到小排列顺序为______________(用元素符号表示),1mol配离子中含有的σ键数目为_________________。
(2)D元素基态原子的最外层电子排布图为_______________________________。
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可以任意比互溶,解释其主要原因为_________________________________。
(4)A元素与B元素可形成分子式为B2A2的某化合物,该化合物的分子具有平面结构,则其结构式为________,该分子中B元素的杂化方式为________。
(5)该配合物溶于水得深蓝色溶液,加入乙醇溶剂,将析出深蓝色的晶体,则加入乙醇的作用是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃,101kPa下,lg C8H18(辛烷)(相对分子质量:114)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是( )
A. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1
B. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.01mol/LNaAc溶液的pH,溶液中HAc、Ac-、H+、OH-浓度的对数值lgc与溶液pH的变化关系如图所示。若pKa=-lgKa,下列叙述错误的是

A. 直线b、d分别对应H+、OH-
B. pH=6时,c(HAc)>c(Ac-)>c(H+)
C. HAc电离常数的数量级为10-5
D. 从曲线a与c的交点可知pKa=pH=4.74
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。
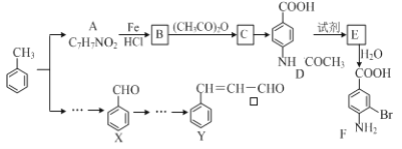
已知:①![]()
![]()
![]()
②![]()
③CH3COOH+CH3COOH→(CH3CO)2O+H2O
请回答下列问题:
(1)下列有关F的说法正确的是______________。
A.分子式是C7H7NO2Br B.F即能与HCl又能与NaOH应生成盐
C.能发生取代反应和缩聚反应 D.1 mol的 F最多可以和2 mol NaOH反应
(2)C→ D的反应类型是 _____。
(3)在合成F的过程中,B→C步骤不能省略,理由是_____________________。
(4)D→E反应所需的试剂是 ___________________。
(5)写出同时符合下列条件的A的同分异构体的结构简式(写出其中1个)_________________。
①苯环上只有两种不同化学环境的氢原子②分子中含有-CHO
(6)利用已知信息,以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。___________ 注:合成路线的书写格式参照如下示例流程图:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
I.实验室制备FeBr2实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将铁粉加热至600—700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始。不断将d中液溴滴入温度为100—120℃的D中。经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。

(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为_____________。C为________________。为防止污染空气,实验时应在F处连接盛___________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用是____________________。
Ⅱ.探究FeBr2的还原性
(3)实验需要200 mL 0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是_____________,需称量FeBr2的质量为:_________。
(4)取10 mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br一被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+
设计实验证明假设2是正确的:________
(5)请用一个离子方程式来证明还原性Fe2+>Br一________:
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验安全问题的叙述中正确的是( )
A.少量的浓硫酸沾到皮肤上时,先用大量的水冲洗,再涂上硼酸溶液
B.取用化学药品时,应特别注意观察药品包装容器上的安全警示标志
C.凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂
D.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2A为二元弱酸。室温时,配制一组c(H2A)+c(HA-) +c(A2-)=0. 100mol·L-1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。下列指定溶液中微粒的物质的量浓度关系不正确的是

A. pH=2 的溶液中:c(H2A)+c(A2-)>c(HA- )
B. E点溶液中:c(Na+)-c(HA-)< 0. 100 mol L-1
C. c(Na+)= 0.100 mol·L-1的溶液中:c(H+) + c(H2A)=c(OH-)+c(A2-)
D. pH=7的溶液中:c(Na+)>2c(A2- )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com