
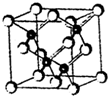
 发光二极管(LED)晶片材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:
发光二极管(LED)晶片材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:| 1 |
| 2 |
| 1 |
| 8 |


科目:高中化学 来源: 题型:
| A、测定中和热时,所用稀NaOH溶液和HCl的物质的量恰好相等以减小实验误差 |
| B、向Fe(OH)3胶体中通电,一段时间后,阴极附近颜色加深 |
| C、向FeCl3溶液中滴加NaOH溶液来制备Fe(OH)3胶体 |
| D、用乙醇萃取溴水中的溴时,分液时有机层从分液漏斗上口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
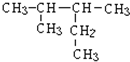 系统命名法命名的名称是
系统命名法命名的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
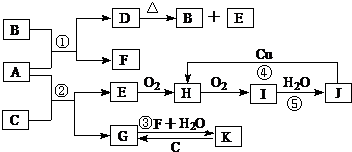
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑨ | B、⑦⑧ |
| C、⑥⑦⑧ | D、②⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com