
分析 (1)①铜和浓硝酸反应生成硝酸铜、二氧化氮和水,二氧化氮是红棕色气体,铁盐溶液呈黄色;
②铜有剩余,铜和稀硝酸反应生成硝酸铜和NO;
③酸性条件下,硝酸根离子具有强氧化性,又继续和铜反应;
(2)n(HNO3)=0.25L×0.2mol/L=0.05mol,n(H2SO4)=0.25L×0.1moL/L=0.025moL,n(H+)=0.05moL+2×0.025moL=0.1mol,n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,根据反应:3Cu+2NO3-+8H+=3Cu2++2NO+4H2O计算;
(3)铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,根据二者质量与电子转移列方程计算.
解答 解:(1)①铜和浓硝酸反应生成硝酸铜、二氧化氮和水,反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,二氧化氮是红棕色气体,铁盐溶液呈黄色,所以看到的现象是:溶液逐渐变黄色,有红棕色气体逸出,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②铜有剩余,随着反应的进行,硝酸浓度逐渐减小,当变为稀硝酸时,铜和稀硝酸反应生成硝酸铜和NO,反应离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
③加入稀硫酸后,氢离子原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应,发生的反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
故答案为:加入稀硫酸后,氢离子与原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应.
(2)在某100mL混酸中,硝酸的物质的量n(HNO3)=0.1L×0.4mol/L=0.04mol,硫酸的物质的量n(H2SO4)=0.1L×2×0.2moL/L=0.04moL,
所以氢离子的物质的量n(H+)=0.04moL+2×0.04moL=0.08mol,
铜粉的物质的量=$\frac{2.56g}{64g/mol}$=0.04mol,依据方程式:
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
3 2 8
0.04mol 0.04mol 0.08mol
可知氢离子不足,故根据H+计算,由方程式可知n(Cu2+)=$\frac{3}{8}$×0.08mol=0.03mol,
所以C(Cu2+)=$\frac{0.03mol}{0.1L}$=0.3mol/L,
故答案为:0.3mol•L-1;
(3)铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,
n(O2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
设Cu、Ag的物质的量分别为x、y,则:
根据质量列方程:x×64g/mol+y×108g/mol=14g
根据电子守恒列方程:2x+1×y=0.05mol×4
解得:x=0.05mol;y=0.1mol
m(Cu)=0.05mol×64g/mol=3.2g;
故答案为:3.2g.
点评 本题考查了硝酸性质的分析应用,离子方程式的书写和计算应用,硝酸的浓度不同导致其氧化性不同,和铜反应时其产物不同,酸性条件下硝酸根离子具有强氧化性,题目难度不大.


科目:高中化学 来源: 题型:填空题
 .若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的电子排布图为
.若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的电子排布图为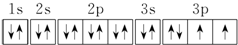 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 | B. | 0.10 | C. | 0.15 | D. | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g•cm-3 | |
| B. | 此溶液中KCl的质量分数为$\frac{74.5}{1.174×1000}$×100% | |
| C. | 密度大于1.174 g•cm-3的KCl溶液是过饱和溶液 | |
| D. | 25℃时,饱和KCl溶液的浓度大于4.0 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| 9540 | 10540 | 11578 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3mol | B. | 4mol | C. | 5mol | D. | 6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验题
实验题| 实验步骤 | 实验现象 |
| I.向编号为①②③的3支试管中,分别加入1mL 20%的蔗糖溶液,向试管②和③中加入0.5mL稀硫酸,并将这3支试管同时水浴加热约5min | 均无明显现象 |
| II.取试管①和②,加入新制氢氧化铜悬浊液,加热至沸腾 | 未见砖红色沉淀 |
| Ⅲ.取试管③,先加入NaOH溶液(或其它碱性溶液)调溶液pH至碱性,再加入新制氢氧化铜悬浊液,加热至沸腾 | 试管③中观察到产生砖红色沉淀 |
| 结论:证明蔗糖在稀硫酸作用下发生了水解反应. | |
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由水电离的c(OH-)=10-14mol•L-1 的溶液:CH3COO-、SO42-、Na+、K+ | |
| B. | 加入铝粉后产生大量氢气的溶液:NH4+、Na+、NO3-、Cl-、SO42- | |
| C. | 能使 pH 试纸变深蓝色的溶液中:S2-、SO32-、CO32-、Na+ | |
| D. | 无色溶液中:K+、Na+、MnO4-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com