
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)盐酸浸取时需要适当加热的原因是_____。
(2)滤渣Ⅰ的成分为_____。
(3)加入H2C2O4时应避免过量,其原因是_____。
(4)用37%的盐酸配制15%的盐酸需用到的仪器有_____(填字母)。
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(5)滤渣Ⅲ需经过洗涤后才能进行后续加工处理的原因是_____。
(6)请补充完整由碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O的实验步骤为_____,过滤,用无水乙醇洗涤2~3次,低温干燥。(实验中可使用的试剂有:冷水,80℃热水,0.1mol·L-1盐酸,6mol·L-1盐酸)
【答案】既加快反应速度又提高浸取率 SiO2、BaSO4 防止生成BaC2O4 ABD 除去表面附着的Ba2+,防止污染环境 灼烧碳酸钡石至恒重,用80℃热水溶解固体,趁热过滤,向滤液中加入稍过量的6mol·L-1盐酸,蒸发浓缩,冷却结晶
【解析】
毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)加入盐酸溶解,生成氯化钙、氯化镁、氯化钡和氯化铁,且少量硫酸根离子与钡离子反应生成硫酸钡,滤渣Ⅰ为SiO2、BaSO4;加入氢氧化钠溶液调至pH=12.5,铁离子、镁离子转化为氢氧化镁、氢氧化铁沉淀进入滤渣Ⅱ,滤液为氯化钡、氯化钙、氯化钠和氢氧化钠,加入草酸反应生成草酸钙沉淀,即滤渣Ⅲ为草酸钙;滤液Ⅲ蒸发浓缩、冷却结晶得到氯化钡晶体。据此分析解答。
(1)盐酸浸取时,适当加热,可以加快反应速度,提高浸取率,故答案为:既加快反应速度又提高浸取率;
(2)酸溶时,SiO2不溶于盐酸和水,且溶液中的SO42-和Ba2+反应生成BaSO4沉淀,则过滤所得滤渣Ⅰ的成分为SiO2、BaSO4,故答案为:SiO2、BaSO4;
(3)加入H2C2O4的目的是除去溶液中的Ca2+,但草酸过量时,也会生成BaC2O4沉淀,故答案为:防止生成BaC2O4;
(4)用37%的盐酸配制15%的盐酸,需要用量筒量取适量的37%的盐酸倒入烧杯中,然后向烧杯中加入一定量的蒸馏水,用玻璃棒搅拌均匀即可,需用到的仪器有量筒、烧杯、玻璃棒,故答案为:ABD;
(5)滤渣Ⅲ为草酸钙,溶液中的氯化钡吸附在草酸钙的表面,钡离子属于重金属离子,会污染环境,因此需经过洗涤后才能进行后续加工处理,故答案为:除去表面附着的Ba2+,防止污染环境;
(6)用碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O,根据题给试剂,可以首先将碳酸钡石粉碎煅烧,使碳酸钡石分解,因为氢氧化钙的溶解度较小,且温度越高,溶解度越小,然后用80℃热水溶解固体,趁热过滤,除去氢氧化钙,将生成的氢氧化钡用6mol·L-1盐酸中和,得到氯化钡溶液,蒸发浓缩,冷却结晶得到BaCl2·2H2O粗品,过滤,用无水乙醇洗涤2~3次,低温干燥即可,故答案为:灼烧碳酸钡石至恒重,用80℃热水溶解固体,趁热过滤,向滤液中加入稍过量的6mol·L-1盐酸,蒸发浓缩,冷却结晶。


科目:高中化学 来源: 题型:
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是

A. d点所示溶液中:c(NH4+)═2c(SO42)
B. C点所示溶液中:c(H+)c(OH)═2c(NH3·H2O)
C. NH3·H2O的电离常数K=104
D. V=40
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如下图所示是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法不正确的是

A. 简单离子半径:②>⑧>⑨
B. 简单氢化物的稳定性:⑤>⑧
C. 最高价氧化物对应的水化物的酸性:⑨>⑧>⑦
D. ①与⑤可形成既含极性键又含非极性键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用电子式表示H2O和MgBr2的形成过程:
H2O__;MgBr2__;
(2)写出CO2、Na2O2、H2O2的电子式:
CO2_;Na2O2__;H2O2___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯的结构或性质,正确的是( )
A.分子中3个碳原子在同一直线上
B.分子中所有原子都在同一平面上
C.分子中共价键的夹角均为120°
D.分子中共价键数为8,其中有一个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如下图:
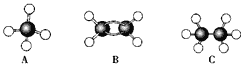
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是________(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是____________;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是________,生成水最多的是________。
(4)在120℃、1.01×105 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g)![]() 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)一段时间后上述反应达到平衡。则下列说法中正确的是________(填字母)。
A.物质A、B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx)
C.当2υ正(A)=υ逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=______________。在保证A浓度不变的情况下,扩大容器的体积,平衡________(填字母)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(3)该反应的逆反应速率与时间的关系如图所示。
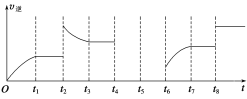
①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:
t2时__________________;t8时_________________________。
②t2时平衡向________(填“正反应”或“逆反应”)方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZO4![]() H2YO4
H2YO4 ![]() H3XO4,下列判断正确的是 ( )
H3XO4,下列判断正确的是 ( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
①②A. ②③ B. ①②③ C. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4。由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图1所示:
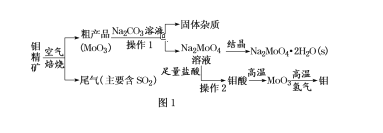
已知:钼酸微溶于水,可溶于液碱和氨水。回答下列问题:
(1)钼精矿焙烧时,每有1molMoS2反应,转移电子的物质的量为______。
(2)钼精矿焙烧时排放的尾气对环境的主要危害是________,请你设计工业上除去该尾气的方法(写出两种“变废为宝”的方法和离子方程式):___________;___________。
(3)由钼酸得到MoO3所用到的硅酸盐材料仪器的名称是_______。
(4)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(MoO42-)=0.80mol/L,c(SO42-)=0.04mol/L,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当BaMoO4开始沉淀时,SO42-的去除率是_____。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液体积变化可忽略不计]
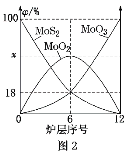
(5)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。
①x=_____。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,若该反应转移6mol电子,则消耗的氧化剂的物质的量为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com