
【题目】常温下,向浓度为0.1mol/L、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图回答下列问题:
(1)该温度时氨水的电离平衡常数K= .
(2)比较b、c、d三点时的溶液中,水电离 的c(OH﹣)大小顺序为 .
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有 .
A.c(H+)c(OH﹣)
B.![]()
C.![]()
D.![]()
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和 NH3H2O两种形式) .
A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3H2O)+c(OH﹣)
B.点 c所示溶液中:c(Cl﹣)=c(NH3H2O)+c(NH4+)
C.点 d所示溶液中:c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣)
D.滴定中可能有:c(NH3H2O)>c(NH4+)>c(OH﹣)>c(Cl﹣)>c(H+)
(5)滴定过程中所用盐酸的pH= , d点之后若继续加入盐酸至图象中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为 . 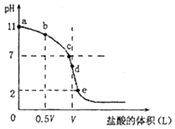
【答案】
(1)10﹣5
(2)d>c>b
(3)BCD
(4)D
(5)1;![]()
【解析】解:(1)滴定前氨水中c(H+)=10﹣11mol/L,利用水的离子积得c(OH﹣)= ![]() mol/L=10﹣3mol/L,一水合氨的电离平衡常数K=
mol/L=10﹣3mol/L,一水合氨的电离平衡常数K= ![]() =
= ![]() =10﹣5 , 所以答案是:10﹣5;(2)在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用,在c点时,溶质为氨水和氯化铵,氨水的电离程度等于于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响,在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡促进,所以b、c、d三点时的溶液中,水电离的c(OH﹣)大小顺序是d>c>b,所以答案是:d>c>b;(3)A.温度不变水的离子积常数不变,所以c(H+)c(OH﹣)不变,故A正确; B.由b点到c点的过程中,c(H+)不断增大,c(OH﹣)不断减小,所以
=10﹣5 , 所以答案是:10﹣5;(2)在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用,在c点时,溶质为氨水和氯化铵,氨水的电离程度等于于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响,在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡促进,所以b、c、d三点时的溶液中,水电离的c(OH﹣)大小顺序是d>c>b,所以答案是:d>c>b;(3)A.温度不变水的离子积常数不变,所以c(H+)c(OH﹣)不变,故A正确; B.由b点到c点的过程中,c(H+)不断增大,c(OH﹣)不断减小,所以 ![]() 增大,故B错误; C.
增大,故B错误; C. ![]() =Kb,温度不变,电离平衡常数不变,故C正确; D.温度不变,电离平衡常数及离子积常数不变,
=Kb,温度不变,电离平衡常数不变,故C正确; D.温度不变,电离平衡常数及离子积常数不变, ![]() =
= ![]() =
= ![]() 不变,故D正确;故选BCD;(4)A.由图象可知,点b反应后溶液是NH4C1与NH3H2O物质的量之比为1:1的混合物,溶液呈碱性,说明NH3H2O电离程度大于NH4C1的水解程度,由电荷守恒可知:c(C1﹣)+c(OH﹣)=c(NH4+)+c(H+),物料守恒为:2c(C1﹣)=c(NH4+)+c(NH3 . H2O),质子守恒为:2c(OH﹣)+c(NH3 . H2O)=c(NH4+)+2c(H+);故A错误; B.由图象可知,点c pH=7,即c(H+)=c(OH﹣),由电荷守恒可知:c(C1﹣)+c(OH﹣)=c(NH4+)+c(H+),故c(NH4+)=c(C1﹣)>c(OH﹣)=c(H+),故B错误; C.由图象可知,点d 体积相同,则恰好完全反应生成NH4C1,NH4C1水解溶液呈酸性,则c(C1﹣)>c(NH4+)>c(H+)>c(OH﹣),故C错误; D.当NH3H2O较多,滴入的 HCl较少时,生成NH4C1少量,溶液中NH3H2O浓度远大于NH4C1浓度,可能出现c(NH3H2O)>c(NH4+)>c(OH﹣)>c(Cl﹣)>c(H+),故D正确;所以答案是:D;(5)由图象可知,点d体积相同,则恰好完全反应生成NH4C1,由NH3H2O~HCl得c(HCl)=
不变,故D正确;故选BCD;(4)A.由图象可知,点b反应后溶液是NH4C1与NH3H2O物质的量之比为1:1的混合物,溶液呈碱性,说明NH3H2O电离程度大于NH4C1的水解程度,由电荷守恒可知:c(C1﹣)+c(OH﹣)=c(NH4+)+c(H+),物料守恒为:2c(C1﹣)=c(NH4+)+c(NH3 . H2O),质子守恒为:2c(OH﹣)+c(NH3 . H2O)=c(NH4+)+2c(H+);故A错误; B.由图象可知,点c pH=7,即c(H+)=c(OH﹣),由电荷守恒可知:c(C1﹣)+c(OH﹣)=c(NH4+)+c(H+),故c(NH4+)=c(C1﹣)>c(OH﹣)=c(H+),故B错误; C.由图象可知,点d 体积相同,则恰好完全反应生成NH4C1,NH4C1水解溶液呈酸性,则c(C1﹣)>c(NH4+)>c(H+)>c(OH﹣),故C错误; D.当NH3H2O较多,滴入的 HCl较少时,生成NH4C1少量,溶液中NH3H2O浓度远大于NH4C1浓度,可能出现c(NH3H2O)>c(NH4+)>c(OH﹣)>c(Cl﹣)>c(H+),故D正确;所以答案是:D;(5)由图象可知,点d体积相同,则恰好完全反应生成NH4C1,由NH3H2O~HCl得c(HCl)= ![]() =0.1mol/L,滴定过程中所用盐酸的pH=1;设盐酸的体积为XL,则过量的盐酸为0.1mol/L×XL﹣0.1Vmol/L×VL,则c(H+)=
=0.1mol/L,滴定过程中所用盐酸的pH=1;设盐酸的体积为XL,则过量的盐酸为0.1mol/L×XL﹣0.1Vmol/L×VL,则c(H+)= ![]() =10﹣2mol/L,解得:X=
=10﹣2mol/L,解得:X= ![]() ,所以答案是:1;
,所以答案是:1; ![]() .
.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于物质的分类说法正确的是
A. 在熔化状态下能导电的化合物一定是电解质
B. 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
C. 粗盐、氨水、纯碱、盐酸均为混合物
D. 纯水的导电性很差,所以水不是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )。
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或记录正确的是( )
A.用托盘天平称取2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g
B.用量筒测得排水法收集制得的氢气体积为50.28 mL
C.用两只250 mL的容量瓶配制0.1 molL﹣1500 mLNaOH溶液
D.常温常压下测得1 mol N2的质量为28 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)某化学课外研究小组,设计实验探究KI溶液和FeCl3溶液反应存在一定的限度.请完成相关的实验步骤和现象.可选试剂:①0.1molL﹣1KI溶液;②0.1molL﹣1 FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4 .
实验步骤:①取5mL 0.1molL﹣1 KI溶液,再滴加5~6滴0.1molL﹣1FeCl3溶液
②充分反应后,将溶液分成三份
③取其中一份,滴加试剂CCl4 , 用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘.
④另取一份,滴加试剂(填试剂序号),若现象为 , 该反应有一定的限度.
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题: 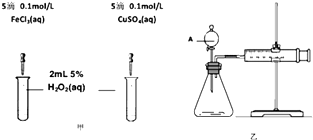
①定性分析:如图甲可通过观察(填现象),定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3溶液更为合理,其理由是 . 写出H2O2在二氧化锰作用下发生反应的化学方程式: .
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中一定需要测量的数据是(填序号).
①收集40mL气体所需要的时间 ②CuSO4溶液和FeCl3溶液的浓度 ③过氧化氢溶液的浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍。Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体,下列说法正确的是
A. 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z)
B. W的气态氢化物比X的稳定
C. XY2与ZY2中的化学键类型相同
D. Y的最高价氧化物对应水化物的酸性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大。A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)A在元素周期表中的位置是__________________。
(2)下列事实能用元素周期律解释的是_____(填字母序号)。
a . D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b. E的气态氢化物的稳定性小于HF
c. WE3的溶液可用于刻蚀铜制的印刷电路板
(3)E的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因是__________。
(4)①工业上用电解法制备D的单质,反应的化学方程式为____________________。
②家用“管道通”的有效成分是烧碱和D的单质,使用时需加入一定量的水,此时发生反应的化学方程式为____________________。
(5)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理。
① 上述反应的离子方程式为__________。
② D的单质与X在高温下反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知在碱性溶液中可发生如下反应:2R(OH)3 + 3C1O- + 4OH- = 2RO4n-+3Cl- +5H2O。则RO4n-中R 的化合价是
A. +3 B. +4 C. +5 D. +6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com