
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是

A.在0~a范围内,只发生中和反应
B.a=0.2
C.ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
【答案】D
【解析】
对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生氢氧化钠与盐酸的中和反应,再发生碳酸钠与盐酸的反应生成碳酸氢钠和氯化钠,最后发生碳酸氢钠与盐酸反应才有二氧化碳气体生成,利用物质的量的关系并结合图象即可解答。
A.向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠,NaOH+HCl=NaCl+H2O,继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3=NaHCO3+NaCl,不放出气体,继续滴加时,发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑;此时开始放出气体,故A错误;
B.生成CO20.1mol,根据碳元素守恒,混合物中碳酸钠的物质的量是0.01mol,所以两步反应:HCl+Na2CO3=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,分别消耗的盐酸的量是0.01mol,消耗0.1molL-1稀盐酸的体积分别是0.1L,所以a=0.3,故B错误;
C.ab段发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,反应的离子方程式为:HCO3-+H+=H2O+CO2↑,故C错误;
D.oa段HCl+Na2CO3=NaHCO3+NaCl消耗0.1molL-1稀盐酸的体积是0.1L,则发生中和反应时消耗0.1molL-1稀盐酸的体积是0.2L,则混合溶液中NaOH物质的量是0.02mol,故原混合溶液中NaOH与Na2CO3的物质的量之比为2:1,故D正确;
故答案为D。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是

A. 根据图①可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
B. 图②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C. 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写错误的是
A. HCO3-的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. Cu2+的水解方程式:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
C. NH4+的水解方程式:NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
D. CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)羟基的电子式________;
(2)﹣C3H7结构简式:________、________;
(3)CH3C(CH3)2CH2C(CH3)3系统命名为________该烃一氯取代物有________种。
(4)支链只有一个乙基且相对分子质量最小的烷烃的结构简式________。
(5)键线式  表示的分子式________。
表示的分子式________。
(6) 中含有的官能团的名称为________。
中含有的官能团的名称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3molA气体和1molB气体混合于固定容积为2L的密闭容器中,发生反应:3A(g)+B(g)C(g)+2D(g)。2min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )

A.当混合气体的密度不再改变时,该反应不一定达到平衡状态
B.2min后,加压会使正反应速率加快,逆反应速率变慢
C.从2min到3min过程中,气体所占的压强不会变化
D.反应过程中A和B的转化率之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示。下列说法不正确的是

A. 图中五点Kw间的关系:B>C>A=D=E
B. 在温度不变的水中,加入适量的NH4Cl,无法实现从A点变到C点
C. D点对应的水溶液中,可能有NH4+、Fe3+、Cl-、NO3-大量同时存在
D. 若处在B点时,将pH =2的硫酸溶液与 pH = 10的KOH溶液等体积混合,所得溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列方程式正确且能设计成原电池的是________。
A.KOH+HCl=KCl+H2O
B.Cu+Fe3+=Fe2++Cu2+
C.Na2O+H2O=2NaOH
D.Fe+H2SO4=FeSO4+H2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(图Ⅰ、图Ⅱ中除连接的铜棒不同外,其他均相同)。有关实验现象,下列说法正确的是___________。

A.图Ⅰ中温度计的示数高于图Ⅱ的示数
B.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
C.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面
D.图Ⅱ中产生气体的速度比Ⅰ快
(3)将锌片和银片浸入稀硫酸中组成原电池,若该电池中两电极的总质量为80,工作一段时间后,取出二者洗净,干燥后称重,总质量为54g,则产生氢气的体积_____mL(标准状况)
(4)将铝片和镁片放入氢氧化钠溶液中,负极的电极反应式为:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定。回答下列问题:
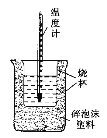
(1)该图中有两处未画出,它们是____________、____________。
(2)在操作正确的前提下提高中和热测定的准确性的关键是____________。
(3)如果用0.50 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将____________(填“偏大”、“偏小”或“不变”);原因是____________。
(4)乙醇是未来内燃机的首选环保型液体燃料。2.0g乙醇完全燃烧生成液态水放出59.43 kJ的热量,表示乙醇燃烧热的热化学方程式为____________________________。
(5)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H=__________kJ·mol-1。
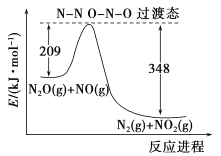
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。常用的自来水消毒剂有二氧化氯(ClO2)和高铁酸钾(K2FeO4)等。
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。
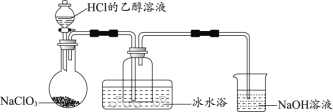
资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为2NaClO3 + 4HCl= 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O。
①冰水浴的作用是____________。
② NaOH溶液中发生的主要反应的离子方程式为________________。
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl4,振荡、静置,观察到____,证明ClO2具有氧化性。
(3)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO2-),需将其转化为Cl-除去。下列试剂中,可将ClO2-转化为Cl-的是_____________________(填字母序号)。
a. FeSO4 b. O3 c. KMnO4 d. SO2
(4)K2FeO4是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备K2FeO4的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌。
①上述制备K2FeO4反应的离子方程式为______________________。
②净水过程中,K2FeO4起到吸附、絮凝作用的原理是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com