
【题目】对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g) ΔH<0,下列结论中不正确的是( )
pC(g)+qD(g) ΔH<0,下列结论中不正确的是( )
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol
D.若温度不变时缩小体积,当A、B、C、D的物质的量浓度之比=m∶n∶p∶q时,说明达到了新的平衡
科目:高中化学 来源: 题型:
【题目】羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。制备少量羟基乙酸钠的反应为
![]()
实验步骤如下:
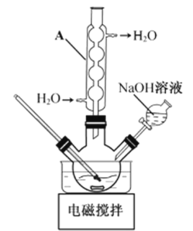
步骤1:如图所示装置的反应瓶中,加入40g氯乙酸、50mL水,搅拌。逐步加入40%NaOH溶液,在95℃继续搅拌反应2小时,反应过程中控制pH约为9。
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤。滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加到适量乙醇中,冷却至15℃以下,结晶、过滤、干燥,得羟基乙酸钠。
(1)步骤1中,如图所示的装置中仪器A的名称是___________;逐步加入NaOH溶液的目的是____________。
(2)步骤2中,蒸馏烧瓶中加入沸石或碎瓷片的目的是_______________。
(3)步骤3中,粗产品溶解于过量水会导致产率__________(填“增大”或“减小”);去除活性炭的操作名称是_______________。
(4)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:

分析图像,以下结论错误的是( )
A. 析氢腐蚀和吸氧腐蚀的速率一样快
B. 在酸性溶液中生铁可能发生吸氧腐蚀
C. 溶液pH≤2时,生铁发生析氢腐蚀
D. 两溶液中负极反应均为Fe – 2e- = Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂,是一种绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
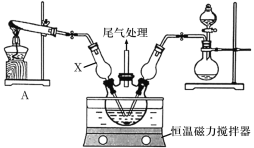
(1)仪器X的名称是______,其主要作用有导气、______。
(2)实验室利用装置A制NH3,发生反应的化学方程式为_______。
(3)反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象有_____。
(4)若体系中NH3过量会导致碱式氯化铜的产量___(填“偏高”、“偏低”或“无影响”),原因为___。
Ⅱ.无水碱式氯化铜组成的测定。称取产品4.29 g,加硝酸溶解,并加水定容至200 mL,得到待测液。
(5)铜的测定:取20.00 mL待测液,经测定Cu2+浓度为0.2 mol·L-1。则称取的样品中 n(Cu2+)=_____mol。
(6)采用沉淀滴定法测定氯:用NH4SCN标准溶液滴定过量的AgNO3(已知:AgSCN是一种难溶于水的白色固体),实验如下图:

①滴定时,应选用下列哪种物质作为指示剂_____(填标号)。
a.FeSO4 b.Fe(NO3)3 c.FeCl3
②重复实验操作三次,消耗NH4SCN溶液的体积平均为10.00 mL。则称取的样品中n(Cl-)=_____mol。
(7)根据上述实验结果可推知无水碱式氯化铜的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H3AO3与足量NaOH溶液反应生成NaH2AO3,25℃时,K(H3AO3)=9.7×10-11。常温下,用0.100mol/L盐酸滴定20.00mL0.100mol/L NaH2AO3溶液。溶液中c(![]() )与-lgc(OH-)的变化关系如图所示。下列说法中正确的是( )
)与-lgc(OH-)的变化关系如图所示。下列说法中正确的是( )
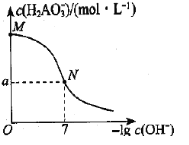
A.H3AO3为三元酸
B.溶液中水电离程度为:M<N
C.a>0.05
D.M到N过程中,溶液中存在c(Na+)=c(![]() )+c(H3AO3)
)+c(H3AO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃分子的球棍模型(如图),据此回答下列问题:
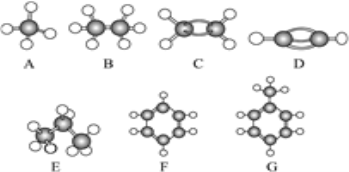
(1)常温下含碳量最高的气态烃是(填对应字母)__;
(2)能够发生加成反应的烃有(填数字)___种;
(3)一卤代物种类最多的是(填对应字母)__;
(4)写出D发生加聚反应的化学方程式:__;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯可用如图所示装置。
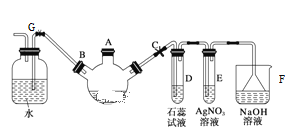
填空:
(1)关闭G夹,打开C夹,向装有少量苯的三颈烧瓶的A口加适量溴,再加入少量铁屑,塞住A口,三颈烧瓶中发生反应的有机反应方程式为___。
(2)E试管内出现的现象为___。
(3)F装置的作用是___。
(4)待三颈烧瓶中的反应进行到仍有气泡冒出时松开G夹,关闭C夹,可以看到的现象是___。
(5)反应结束后,拆开装置,从A口加入适量的NaOH溶液,然后将液体倒入__中(填仪器名称),振荡静置,从该仪器__口将纯净溴苯放出(填“上”或“下”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辛烯醛是重要化工原料,某小组拟用正丁醛制备辛烯醛并探究其结构。
[制备实验]
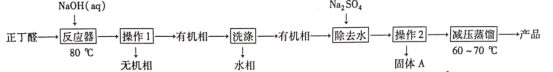
已知:①正丁醛的沸点为75.7℃。辛烯醛沸点为177℃,密度为0.848 g·cm-3,不溶于水。
②CH3CH2CH2CHO![]()
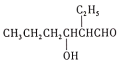
![]()
![]()
(1)在如图1三颈瓶中加入12.6 mL 2% NaOH溶液,在充分搅拌下,从恒压滴液漏斗慢慢滴入10 mL正丁醛。最适宜的加热方式是___________;使用冷凝管的目的是____________。
(2)操作1中使用的主要仪器名称是___________,有机相从___________(填“上”或“下”)口取出。
(3)判断有机相已洗涤至中性的操作方法:___________。
(4)操作2的名称是_____________;固体A的摩尔质量为322 g·mol-1,固体A的化学式为___________。
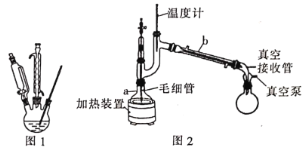
(5)利用图2装置进行“减压蒸馏”。下列有关说法错误的是___________。(填选项)
A 温度计示数为177℃,指示馏分温度
B 随着温度计液泡高度的提升,所得液体的沸点升高
C 毛细管的作用和沸石相似,防止液体暴沸
D 实验结束后,应先关闭冷凝水,再关闭真空泵
[性质实验]
资料显示:醛类(RCHO)在常温下能与溴水、酸性高锰酸钾溶液反应;在加热条件下能与银氨溶液、新制氢氧化铜浊液反应。
(6)为了证明辛烯醛含有碳碳双键,设计如下方案,能达到实验目的的是________。(填选项)
a 取少量溴水,滴加辛烯醛,振荡,溶液褪色
b 取少量酸性高锰酸钾溶液,滴加辛烯醛,振荡,溶液褪色
c 取少量辛烯醛,加入足量的银氨溶液,水浴加热充分反应后,冷却,在上层清液中先滴加稀盐酸酸化,再滴加溴水,振荡
d 取少量辛烯醛,加入足量的新制Cu(OH)2浊液,加热充分反应后,冷却,在上层清液中先滴加稀盐酸酸化,再滴加溴水,振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝) +3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式_________。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______和________。含有12mol σ键的K4[Fe(CN)6的物质的量为________mol。
(3)黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为_____,电负性由大到小的排序为________。
(4)Fe、Na、K的晶体结构如图所示:
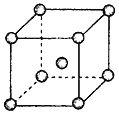
① 钠的熔点比钾更高,原因是__________________________。
② Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com