
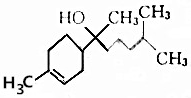
| A. | 分子式为C15H26O | B. | 能和NaHCO3溶液反应生成CO2 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能与乙酸发生取代反应 |
分析 A.根据结构简式确定分子式;
B.该有机物中含有碳碳双键和醇羟基,具有烯烃和醇的性质;
C.碳碳双键能被酸性高锰酸钾溶液氧化;
D.该分子中含有醇羟基,具有醇的性质.
解答 解:A.根据结构简式确定分子式为C15H26O,故A正确;
B.该有机物中含有碳碳双键和醇羟基,具有烯烃和醇的性质,该物质不含羧基,所以不能和碳酸氢钠反应,故B错误;
C.该物质中含有碳碳双键,碳碳双键能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故C正确;
D.该分子中含有醇羟基,具有醇的性质,一定条件下能和乙酸发生酯化反应(或取代反应),故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯烃和醇的性质,题目难度不大.


科目:高中化学 来源: 题型:解答题
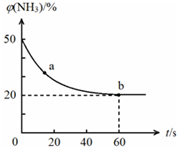 合理应用和处理氮的化合物,在生产生活中有重要意义.密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?CO(NH2)2 (s)+H2O(g),混合气体中NH3的物质的量分数[ϕ(NH3)]随时间变化关系如图所示.则a点的正反应速率υ正(CO2)>b点的逆反应速率υ逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是75%.
合理应用和处理氮的化合物,在生产生活中有重要意义.密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?CO(NH2)2 (s)+H2O(g),混合气体中NH3的物质的量分数[ϕ(NH3)]随时间变化关系如图所示.则a点的正反应速率υ正(CO2)>b点的逆反应速率υ逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是75%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
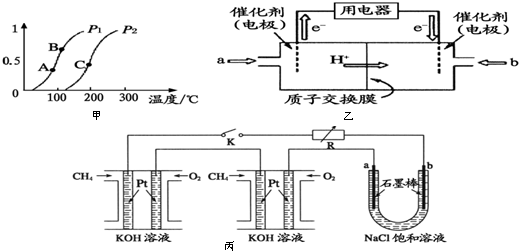
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡 常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 25℃,等物质的量浓度的CH3COO-、ClO-、CO32-和SO32-,结合质子能力最强的是ClO- | |
| B. | 少量的SO2通入Na2CO3溶液中反应的离子方程式为:SO2+H2O+2CO32-═2HCO3-+SO32- | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-═CO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
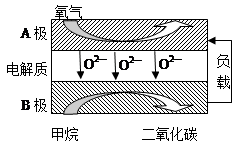
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe2+、Cl-、SO42- | B. | Na+、K+、Cl-、SO42- | ||
| C. | Mg2+、AlO2-、Cl-、SO42- | D. | K+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com