
| A. | 放热反应在常温下均能自发进行 | |
| B. | 原电池工作时所发生的反应一定有氧化还原反应 | |
| C. | 加热时,化学反应只向吸热反应方向进行 | |
| D. | 化学平衡常数的表达式与化学反应方程式的书写无关 |
分析 A.只有持续加热才反应的,一般为吸热反应,反之,一般为放热反应;
B.原电池工作时,是将化学能转化为电能;
C.加热时,化学反应不只向吸热反应方向进行;
D.化学平衡常数的大小只与温度有关,化学平衡常数的表达式与化学反应方程式的书写有关.
解答 解:A.放热反应是指:反应物的总能量大于生成物的总能量,与常温下能自发进行无关,如:碳在空气中燃烧,须加热达到碳的着火点才可进行,故A错误;
B.原电池工作时,是将化学能转化电能,有电流产生,则有电子的定向移动,所以所发生的反应一定有氧化还原反应,故B正确;
C.加热时,提供能量,无论是吸热反应,还是放热反应,反应速率都要加快,故C错误;
D.化学平衡常数的表达式为:化学平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,与化学反应方程式的书写有关,故D错误;
故选B.
点评 本题主要考查基础知识的辨析,主要是化学反应能量变化,反应自发进行的判断依据,结合题意,根据所学知识,注重知识的内涵和外延,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②①③④ | C. | ④①③② | D. | ③①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绚丽缤纷的烟花中添加了含钾、钠、铁、铜等金属元素的化合物 | |
| B. | 明矾和漂白粉常用于自来水的净化,且原理相同 | |
| C. | 食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质 | |
| D. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 现象等 |
| Ⅰ | 先向2mL 0.1mol/L FeC12溶液中滴加KSCN溶液,再滴加新制氯水 | ①滴加KSCN溶液后,溶液无明显变化;滴加新制氯水后,溶液变变成红色 ②FeC12溶液与新制氯水反应的离子方程式2Fe2++Cl2═2Fe3++2Cl- |
| Ⅱ | 先向2mL 0.1mol/L FeC13溶液中滴加KSCN溶液,再滴加0.1mol/L KI溶液 | 滴加KSCN溶液后,溶液变红色;滴加KI溶液后,红色无明显变化 |
| 编号 | 操作 | 现象等 |
| Ⅲ | 先向2mL 0.1mol/L KI溶液中滴加1mL 0.1mol/L FeC13溶液,再滴加KSCN溶液 | 滴加FeC13溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变为红色.根据实验现象可以推测出Fe3+有可能与I-发生了氧化还原反应. |
| 编号 | 操作 | 现象及结论 |
| Ⅳ | 向2mL 0.1mol/L KI溶液中滴加1mL 0.1mol/L FeC13溶液,再滴加①再滴加淀粉溶液(或CCl4;或铁氰化钾溶液) | 现象:溶液变蓝. 结论:Fe3+能与I-发生氧化还原反应生成②I2,③Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
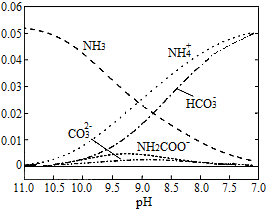 ,
,| A. | 在pH=8.0 时,c(NH4+)>c(HCO3-)>c(NH2COO-)=c(CO32-) | |
| B. | 随着C02的不断通入,Kw不变,但是水的电离受到促进 | |
| C. | 在溶液中pH不断降低的过程中,最终产物中含有NH2COO- | |
| D. | D、随着C02的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}{H}_{2}O)}$ 不断减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
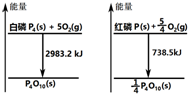
| A. | 白磷比红磷稳定 | |
| B. | 白磷燃烧产物比红磷燃烧产物稳定 | |
| C. | 1mol白磷转变为红磷放出2244.7kJ的热量 | |
| D. | 红磷燃烧的热化学方程式:4P(s)+5O2(g)→P4O10(s)+2954 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com