
| A. | 1mol•L-1 | B. | 2mol•L-1 | C. | 3mol•L-1 | D. | 4mol•L-1 |
分析 混合溶液分成两等份,每份溶液浓度相同,一份加入含a1mol 硫酸钠的溶液,发生反应Ba2++SO42-=BaSO4↓,恰好使钡离子完全沉淀,可知该份中n(Ba2+)=(Na2SO4);
另一份加入含3mol 硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+),再利用电荷守恒可知每份中2n(Ba2+)+n(K+)=n(Cl-),据此计算每份中n(K+),根据c=$\frac{n}{V}$计算钾离子浓度.
解答 解:混合溶液分成两等份,每份溶液浓度相同.一份加入含1 mol 硫酸钠的溶液,发生反应Ba2++SO42-=BaSO4↓,恰好使钡离子完全沉淀,可知该份中n(Ba2+)=(Na2SO4)=1mol,
另一份加入含3mol 硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+)=3mol,
根据电荷守恒可知每份中满足:2n(Ba2+)+n(K+)=n(Cl-),则n(K+)=3mol-2mol=1mol,
所以钾离子浓度为:c(K+)=$\frac{1mol}{0.25L}$=4mol•L-1,
故选D.
点评 本题考查离子反应的计算、混合物反应的计算,为高频考点,题目难度中等,明确发生的反应及物质的量关系为解答的关键,试题侧重分析、计算能力的考查.


 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲和乙一定是同分异构体 | B. | 甲和乙的实验式一定相同 | ||
| C. | 甲和乙不可能是同系物 | D. | 甲和乙的分子式一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z2+能促进水的电离 | |
| B. | 常见单质的熔点:X>Z>Y | |
| C. | 若元素R的某种微粒R2-,则R不一定与Y同主族 | |
| D. | Y与W组成的二元化合物是制耐高温坩埚的常用材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na | B. | Na2O | C. | Na2O2 | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | V=40 | |
| B. | c点所示溶液中:c(H+)-c(OH-)=2c(NH3•H2O) | |
| C. | d点所示溶液中:c(NH4+)=2c(SO42-) | |
| D. | NH3•H2O的电离常数K=10-4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加大清洁能源的开发利用,提高资源的利用率 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 | |
| C. | 加大铅酸蓄电池、含汞锌锰干电池的生产,满足消费需求 | |
| D. | 对工业废水、生活污水净化处理,减少污染物的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
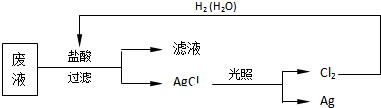
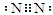 .
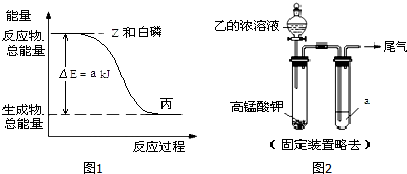
.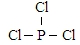 .白磷固体和 Z 气体反应,生成 1mol 液态丙时,能量变化如图1所示,写出该反应的热化学方程式:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol.已知 1mol 白磷固体和 Z 气体反应,生成固态丁时,放热 bkJ,则 1mol 固态丁转化为液态丙时的反应热△H=(a-$\frac{b}{4}$ )kJ/mol.
.白磷固体和 Z 气体反应,生成 1mol 液态丙时,能量变化如图1所示,写出该反应的热化学方程式:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol.已知 1mol 白磷固体和 Z 气体反应,生成固态丁时,放热 bkJ,则 1mol 固态丁转化为液态丙时的反应热△H=(a-$\frac{b}{4}$ )kJ/mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com